Содержание
Этиленгликоль, структурная формула, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.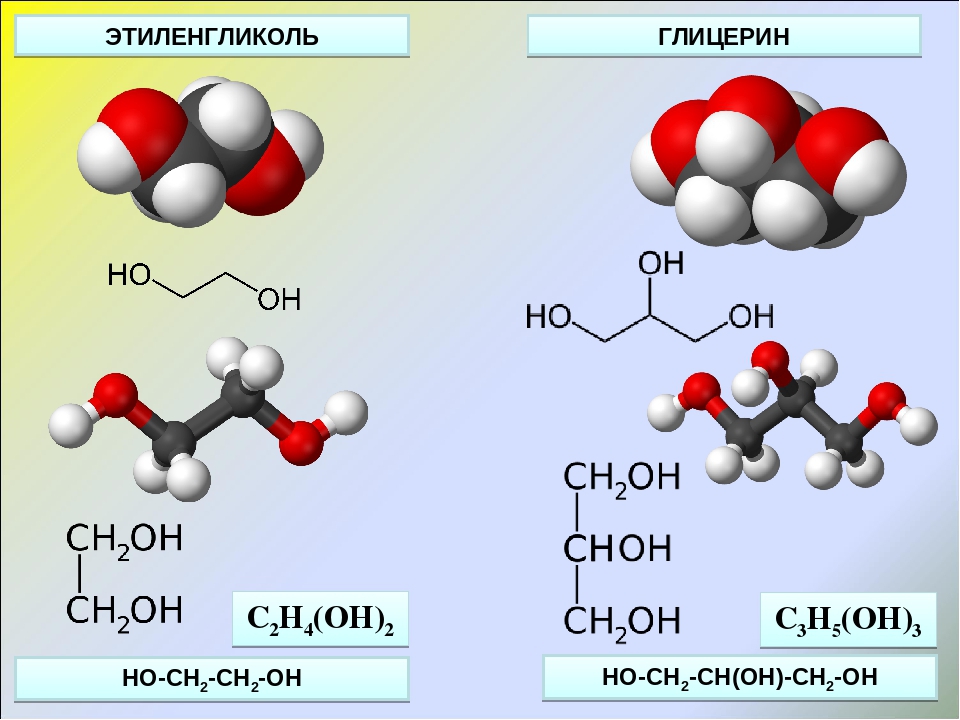
Чтобы получить подробное описание элемента, кликните по его названию.
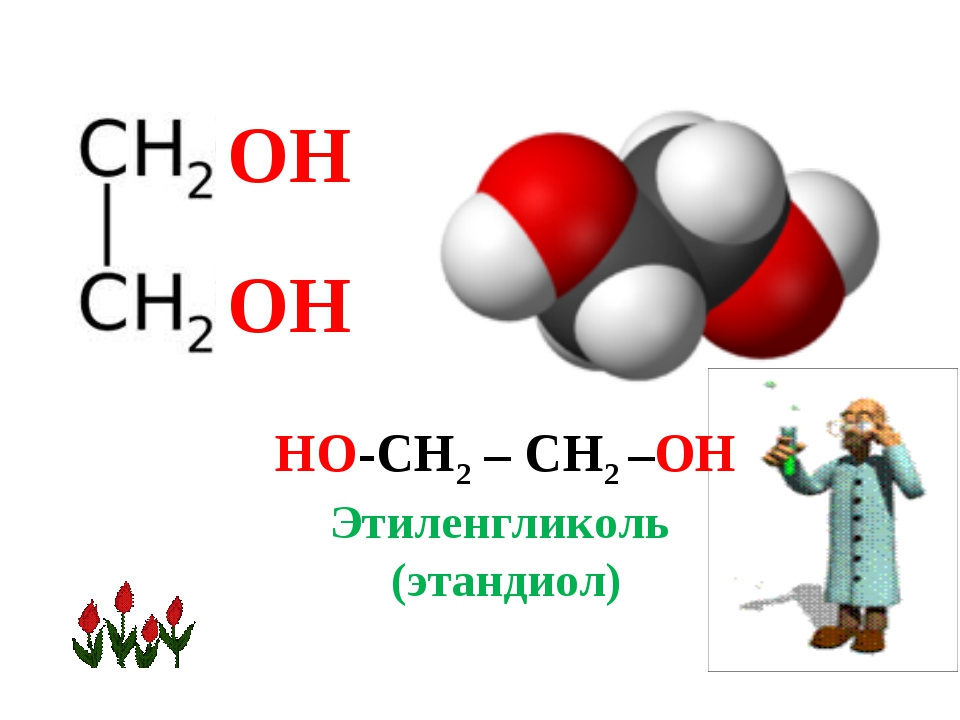
Формула этиленгликоля в химии
Определение и формула этиленгликоля
ОПРЕДЕЛЕНИЕ
Этиленгликоль (этан-1,2-диол ) – сложное кислородсодержащее органическое соединение, двухатомный спирт.
Химическая формула –
Молярная масса равна г/моль.
Физические свойства – это сиропообразная структура без цвета и запаха, сладкая на вкус.
По мнению большинства исторических источников, французский химик Вюрц первоначально получил этиленгликоль в 1856. Он обрабатывал йодистый этилен ацетатом серебра, а затем гидролизовал полученный «Этилен диацетат» гидроксидом калия. Вюрц назвал это новое соединение «гликоль», потому что ему присущи качества как этанола (с одной гидроксильной группой) так и и глицерина (с тремя гидроксильными группами).
Химические свойства этиленгликоля
- Этиленгликоль реагирует с различными щелочными и щелочно-земельными металлами:
- В реакции с обменивают одну или несколько гидроксильных групп на атомы галогена:
Получение
Этиленгликоль производят из этилена через промежуточное образование этиленоксида.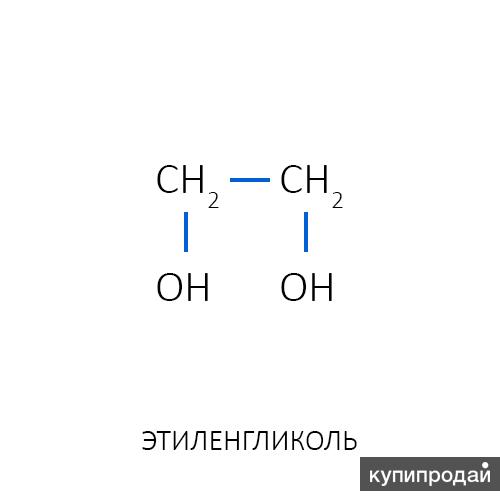 Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
Этиленоксид реагирует с водой с образованием этиленгликоля согласно химическому уравнению:
Качественная реакция
Качественной реакцией является взаимодействие спирта со свежеосажденным . Наблюдается растворение осадка и окрашивание раствора в насыщенно синий цвет — в результате образования гликолята меди (II).
Применение
Этиленгликоль в основном используется в составе антифризов , а также в качестве сырья при производстве сложных полиэфиров, таких как полиэтилентерефталат (ПЭТ) .
Примеры решения задач
ПРИМЕР 1
| Задание | Сколько щавелевой кислоты можно получить из 6,2 г этиленгликоля? |
| Решение |
Рассмотрим химическую реакцию получения щавелевой кислоты из двухатомного спирта этиленгликоля:
Из стехиометрии следует, что
г
|
| Ответ | г |
|
Понравился сайт? Расскажи друзьям! |
|
||
Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт.
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.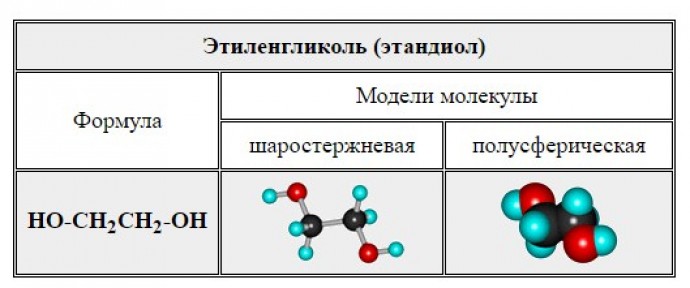
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода. |
CH2(OH)-CH2OH + 2K → CH2(OK)-CH2OK + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
CH2(OH)-CH2OH + 2HBr → CH2Br-CH2Br + 2H2O
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль: |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180оС) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
2C2H4(OH)2 + 5O2 = 4CO2 + 6H2O
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
CH2(OH)-CH2OH → CHO-CHO + 2H2
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
CH2Cl-CH2Cl + 2NaOH → CH2OH-CH2OH + 2NaCl
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2→ CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
Этиленгликоль (моноэтиленгликоль): химический состав и свойства, особенности, где используется
Этиленгликоль (альтернативные названия – диоксиэтан, этандиол, моноэтиленгликоль) – представитель двухатомных спиртов.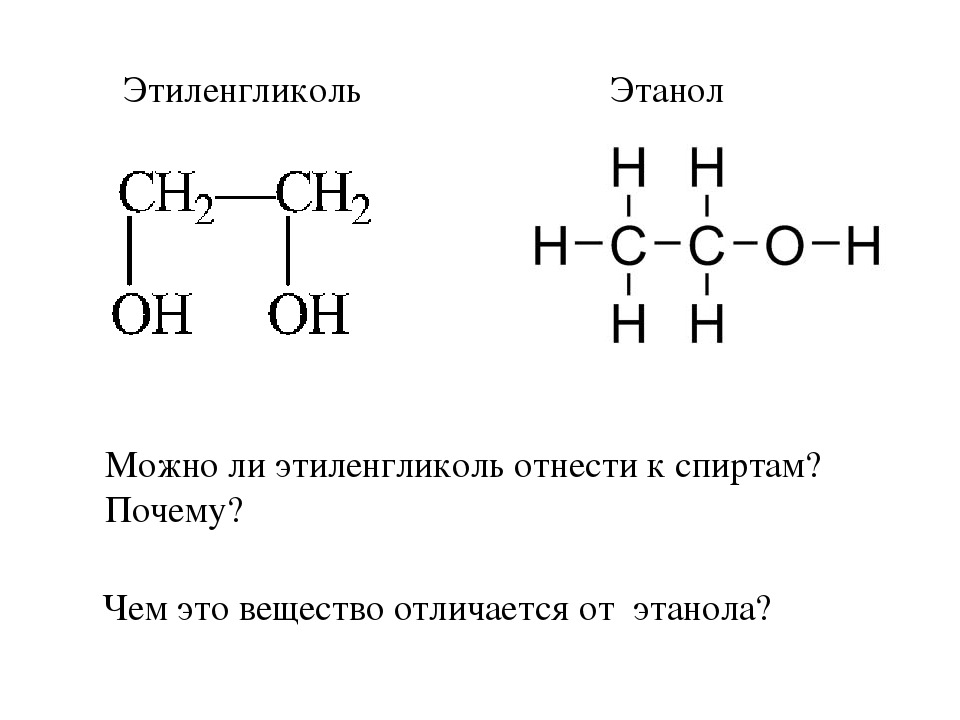 Химическая формула вещества – С2H6О2. Внешне это бесцветная прозрачная жидкость без запаха. По общепринятой международной классификации отнесен к третьему классу опасности. Употребление внутрь 100 мл этиленгликоля смертельно для человека. Пары диоксиэтана токсичны, попадание в чистом виде или в водном растворе опасно для здоровья и жизни.
Химическая формула вещества – С2H6О2. Внешне это бесцветная прозрачная жидкость без запаха. По общепринятой международной классификации отнесен к третьему классу опасности. Употребление внутрь 100 мл этиленгликоля смертельно для человека. Пары диоксиэтана токсичны, попадание в чистом виде или в водном растворе опасно для здоровья и жизни.
Физические свойства этиленгликоля
- Молярная масса – 62 грамма/моль;
- Температура воспламенения зависит от концентрации: 112-124 градуса;
- Коэффициент оптического преломления – 1,4318;
- Температура самовоспламенения – 380 градусов;
- Температура замерзания чистого гликоля – минус 22 градуса;
- Температура кипения – 197,3 градуса;
- Плотность – 1,111 грамма на кубический сантиметр.
Физические и теплофизические свойства вещества зависят от концентрации в растворе. Высококонцентрированный гликоль выдерживает нагрев до высокой температуры, поэтому он подходит для теплоносителей инженерных систем.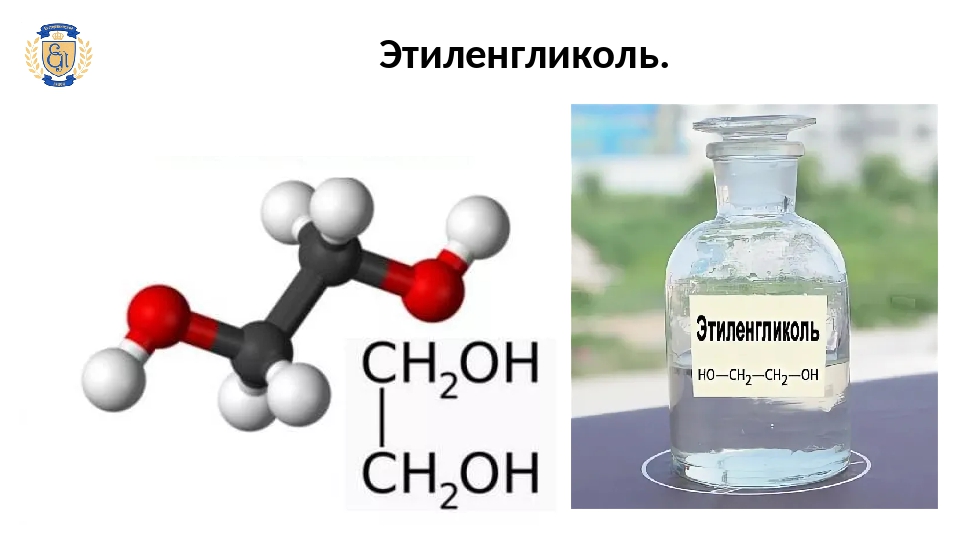 Низкая температура кристаллизации (достигает нижних пределов в 65 градусов ниже нуля примерно при 40 % в растворе) позволяет использовать диоксиэтан в качестве сырья для антифризов систем охлаждения.
Низкая температура кристаллизации (достигает нижних пределов в 65 градусов ниже нуля примерно при 40 % в растворе) позволяет использовать диоксиэтан в качестве сырья для антифризов систем охлаждения.
История и современное производство
Этиленгликоль впервые синтезировал французский химик Вюрц в середине XIX века. Сырьем для получения гликоля стал сначала диацетат, а затем – этиленоксид. Первоначально синтезированное вещество не получило практического применения. Спустя 50 лет этиленгликоль активно использовали при производстве взрывчатых веществ. Низкая себестоимость производства, высокая плотность, подходящие физические характеристики позволили вытеснить глицерин, служивший для изготовления взрывчатки.
В промышленных масштабах двухатомный спирт начали производить в 20-ых годах прошлого столетия в США. Американские специалисты спроектировали и построили завод в Западной Вирджинии и наладили массовое изготовления гликоля. На протяжении долгих лет его закупали практически все крупные компании, специализирующиеся на изготовлении динамита.
Сегодня этиленгликоль в промышленных масштабах синтезируется в ходе гидратации этилена двумя способами:
- С применением низкоконцентрированной серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов;
- Под давлением в 10 атмосфер и температуре в 200 градусов.
На выходе получается смесь, содержащая до 90 процентов чистого высококонцентрированного этиленгликоля. Побочные продукты реакции – полимергомологи и триэтиленгликоль, нашли широкое применение в промышленности. Системы охлаждения воздуха, производство пластификаторов и препаратов для дезинфекции – наиболее популярные сферы использования.
Применение этиленгликоля в промышленности
- Реакции органического синтеза. Гликоль обладает высокой химической активностью, поэтому используется в качестве растворителя, средства защиты изофорона и карбонильных групп. Спирт не кипит при высоких температурах, за чет чего подходит для специальной авиационной жидкости.
 Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.
Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.
- Растворитель для красящих соединений.
- Производство взрывчатого вещества – нитрогликоля (более дешевый и доступный аналог нитроглицерина).
- Газодобывающая отрасль. Этиленгликоль исключает образование гидрата метана на трубах и поглощает излишнюю влагу.
- Криопротекция. Вещество активно используется при производстве жидкостей для охлаждения компьютерной и цифровой техники, изготовлении конденсаторов и получении 1,4-диоксина.
Охлаждающие жидкости на основе этиленгликоля
Двухатомный спирт используется при изготовлении антифризов для охлаждающих систем двигателя, теплоносителей инженерных систем отопления и кондиционирования воздуха. Раствор с деминерализованной водой и пакетом антикоррозионных присадок обладает антикавитационными и антипенными свойствами.
Преимущество этиленгликоля – низкая температура кристаллизации в сравнении с водой.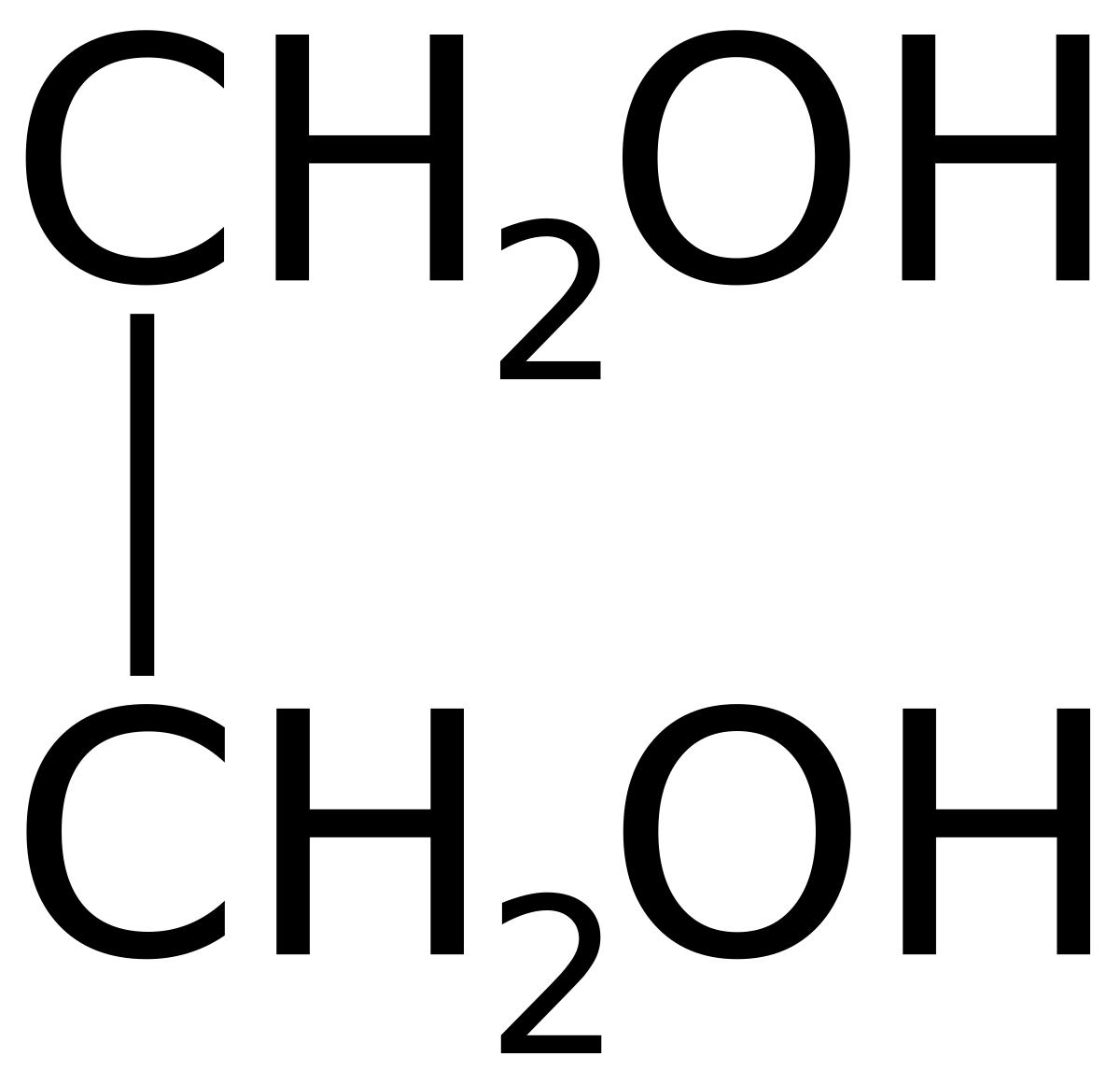 Даже при достижении точки замерзания гликоль имеет более низкий коэффициент температурного расширения в сравнении с водой (на 1,5-3 % меньше). Высокая температура кипения позволяет использовать водно-гликолевую смесь в экстремальных производственных условиях, при подогревании нефти и газа и других технологических процессах.
Даже при достижении точки замерзания гликоль имеет более низкий коэффициент температурного расширения в сравнении с водой (на 1,5-3 % меньше). Высокая температура кипения позволяет использовать водно-гликолевую смесь в экстремальных производственных условиях, при подогревании нефти и газа и других технологических процессах.
Дополнительные преимущества антифризов на основе этиленгликоля:
- Разнообразие выбора концентраций для различных условий эксплуатации;
- Стабильные рабочие параметры и теплофизические свойства на протяжении длительного периода;
Вам могут быть интересны следующие товары
Вам могут быть интересны услуги
Формула Этиленгликоля структурная химическая
Структурная формула
Истинная, эмпирическая, или брутто-формула: C2H6O2
Химический состав Этиленгликоля
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| C | Углерод | 12,011 | 2 | 38,7% |
| H | Водород | 1,008 | 6 | 9,7% |
| O | Кислород | 15,999 | 2 | 51,6% |
Молекулярная масса: 62,068
Этиленглико́ль (гликоль; 1,2-диоксиэтан; этандиол-1,2), HO—CH2—CH2—OH — двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50 % в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров.
 Это второе основное применение;
Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана или комплекса диметилсульфат-ДМФА 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент жидкости «И», используемой для предотвращения обводнения авиационных топлив.

- В качестве криопротектора
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1—2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8- 6,4 % (по объему).
Этиленгликоль токсичен. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100—300 мл этиленгликоля (1,5-5мл на 1 кг массы тела). Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол.
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой.
ICSC 0270 — ЭТИЛЕНГЛИКОЛЬ
ICSC 0270 — ЭТИЛЕНГЛИКОЛЬ
| ЭТИЛЕНГЛИКОЛЬ | ICSC: 0270 |
| Май 2018 |
| CAS #: 107-21-1 |
|
| EINECS #: 203-473-3 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ |
Горючее.
|
НЕ использовать открытый огонь. | Использовать распыленную воду, порошок, спиртоустойчивую пену, двуокись углерода. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЯ ТУМАНА! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Кашель. Головокружение. Головная боль. | Применять вентиляцию. | Свежий воздух, покой. Обратиться за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Снять загрязненную одежду. Промыть кожу большим количеством воды или принять душ. |
| Глаза | Покраснение. Боль. | Использовать защитные очки. |
Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью.
|
| Проглатывание | Боль в горле. Тошнота. Рвота. Боль в животе. Сонливость. Потеря сознания. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. НЕ вызывать рвоту. Обратиться за медицинской помощью. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: респиратор с фильтром для органических газов и паров, подходящий для концентрации вещества в воздухе. Как можно быстрее собрать пролитую жидкость в закрывающиеся емкости. Смыть остаток большим количеством воды. |
Согласно критериям СГС ООН
ОСТОРОЖНО
Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от сильных окислителей, сильных оснований и сильных кислот. Хранить сухим. Вентиляция вдоль пола. Хранить сухим. Вентиляция вдоль пола.
|
|
| УПАКОВКА | |
|
Исходная информация на английском языке подготовлена группой международных экспертов, работающих от имени МОТ и ВОЗ при финансовой поддержке Европейского Союза. |
| ЭТИЛЕНГЛИКОЛЬ | ICSC: 0270 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: HOCH2CH2OH |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
TLV: (пар и аэрозоль): 25 ppm как TWA. TLV: (пар): 50 ppm как STEL. TLV: (inhalable aerosol): 10 mg/m3 как STEL. A4 (не классифицируется как канцероген для человека). EU-OEL: 52 mg/m3 как TWA; 104 mg/m3 как STEL; (кожа) |
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| Воздействие вещества на окружающую среду было адекватно исследовано, но никаких существенных воздействий обнаружено не было. |
| ПРИМЕЧАНИЯ |
|---|
| В случае отравления этим веществом необходимо специфическое лечение; должны иметься в наличии соответствующие средства с инструкциями. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Физические свойства этиленгликоля и глицерина :: HighExpert.RU
Этиленгликоль (этандиол, гликоль) — это простейший двухатомный спирт, его химическая формула HO-CH2CH2-OH. Этиленгликоль широко применяется в качестве антифриза, также используется в органическом синтезе. В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Этиленгликоль не имеет запаха и обладает сладковатым вкусом. Этиленгликоль токсичен.
Глицерин (триоксипропан) — это простейший представитель трехатомных спиртов, его химическая формула HOCH2CH(OH)-CH2OH (C3H8O3). Глицерин находит широкое применение в при изготовлении бумаги, косметики и мыла, а также в производстве кондитерских изделий и алкогольных напитков; применяется в технологических процессах, предотвращает замораживание рабочих жидкостей, способствует продлению срока службы деталей из эластомеров. Глицерин является бесцветной вязкой жидкостью, неограниченно растворимой в воде. Обладает сладким вкусом.
Теплофизические свойства этиленгликоля
При нормальных условиях вязкость этиленгликоля в ~19 раз больше вязкости воды. Теплофизические свойства водного раствора этиленгликоля зависят от его содержания в смеси.
| Температура | Плотность, ρ | Удельная теплоемкость, Cp | Кинематическая вязкость**, ν | Теплопроводность, λ | Коэффициент температуропроводности, a | Число Прандтля, Pr |
| оС | кг/м3 | кДж / (кг • К) | м2/с • 106 | Вт/(м • К) | м2/с • 107 | — |
| 0 | 1130,1 | 2,294 | 67,62 | 0,242 | 0,933 | 615,0 |
| 20 | 1116,1 | 2,382 | 19,17 | 0,249 | 0,938 | 204,0 |
| 40 | 1100,8 | 2,474 | 8,69 | 0,256 | 0,938 | 93,0 |
| 60 | 1087,1 | 2,562 | 4,75 | 0,260 | 0,931 | 51,0 |
| 80 | 1077,0 | 2,650 | 2,98 | 0,262 | 0,922 | 32,4 |
| 100 | 1057,9 | 2,742 | 2,03 | 0,263 | 0,908 | 22,4 |
При проведении инженерных расчётов проще использовать приближённые формулы для определения физических свойств этиленгликоля.
Плотность этиленгликоля
⋆ [ кг/м3 ]
Теплоёмкость этиленгликоля
⋆ [ Дж/(кг • К) ]
Теплопроводность этиленгликоля
⋆ [ Вт/(м • K) ]
Кинематическая вязкость этиленгликоля
⋆ [ м2/с ]
Температуропроводность этиленгликоля
[ м2/с ]
Число Прандтля
[ — ]
Динамическая вязкость этиленгликоля
[ Па • c ]
Теплофизические свойства глицерина
В таблице приведены физические свойства глицерина, которые существенно зависят от температуры этой жидкости. При температуре +20 градусов Цельсия динамическая вязкость глицерина составляет около 1,41…1,48 Па•c и снижается в ~100 раз при повышении температуры до +100 градусов Цельсия. Теплофизические свойства водного раствора глицерина зависят от его концентрации в смеси.
Кинематическая вязкость глицерина при нормальных условиях примерно в 1100 раз превышает вязкость воды.
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Динамическая вязкость**, μ | Кинематическая вязкость***, ν | Теплопроводность, λ | Коэффициент температуропроводности, a | Число Прандтля, Pr | Поверхностное натяжение, σ |
| оС | кг/м3 | кДж / (кг • К) | (Н • c/м 2) • 103 | м2/с • 106 | Вт/(м • K) | м2/с • 107 | — | Н/м • 103 |
| 0 | 1273 (1275) | 2,261 | 12070 (12100) | 9466,67 | 0,283 | 0,982 | 96432 | — |
| 10 | 1267 (1269) | 2,320 | 3900 (3950) | 3078,14 | — | 31915 | — | |
| 20 | 1262 (1263) | 2,386 (2,35) | 1410 (1480) | 1111,11 | 0,284 | 0,957 | 11846 | (59,4) |
| 30 | 1255 (1257) | — | 612 (600) | 487,65 | — | 5154 | (59,0) | |
| 40 | 1249 (1251) | (2,45) | 284 (330) | 224,86 | 0,286 | 0,933 | 2827 | (58,5) |
| 50 | (1244) | 2,512 | 182 (180) | — | (0,283) | 0,905 | 1598 | (58,0) |
| 60 | (1238) | (2,56) | 81,3 (102) | 64,68 | — | — | 919 | (57,4) |
| 70 | — | — | 50,6 (59) | — | — | — | — | (56,7) |
| 80 | (1224) | (2,67) | 31,9 (35) | 25,5 | 0,285 | 0,872 | 328 | (55,9) |
| 90 | — | — | 21,3 (21) | — | — | (55,0) | ||
| 100 | (1208) | (2,79) | 14,8 (13) | 15,7 | (0,289) | 0,857 | 125 | (54,2) |
| 110 | 1202 | — | — | — | — | — | — | (53,2) |
| 120 | 1194 (1188) | (2,90) | (5,2) | 4,37 | — | — | — | (52,2) |
| 130 | 1187 | — | — | — | (51,1) | |||
| 140 | 1180 (1167) | (3,01) | (1,8) | 1,54 | — | — | — | (50,0) |
| 160 | 1164 (1143) | (3,12) | (1,0) | 0,96 | — | — | — | — |
При проведении инженерных расчетов удобнее использовать приближённые формулы для определения физических свойств глицерина.
Плотность глицерина
⋆ [ кг/м3 ]
Теплоёмкость глицерина
⋆ [ Дж/(кг • К) ]
Теплопроводность глицерина
⋆ [ Вт/(м • K) ]
Кинематическая вязкость глицерина
⋆ [ м2/с ] формула для диапазона температур от 273 до 313 K
Динамическая вязкость глицерина
[ Па • c ]
Число Прандтля
[ — ]
Температуропроводность глицерина
[ м2/с ]
⋆ Приближённые формулы получены авторами настоящего сайта.
Размерность величин: температура — К (Кельвин).
Приближённые формулы действительны в диапазоне температур от 273 К до 333 К.
* Табличные подготовлены по материалам справочника «Свойства веществ», а также данным с сайта https://www.dow.com/
Вязкость указана для концентрации 100%.
Табличные значения кинематической вязкости рассчитаты исходя из имеющихся данных динамической вязкости и плотности.
Разница между этиленгликолем и полиэтиленгликолем
Основное различие — этиленгликоль и полиэтиленгликоль
Хотя у них почти схожие названия, полиэтиленгликоль и этиленгликоль — очень разные соединения в зависимости от их химической структуры и общих свойств. Этиленгликоль — это спиртовое соединение. Полиэтиленгликоль представляет собой соединение простого полиэфира. Оба эти соединения смешиваются с водой из-за наличия -ОН-групп. Основное различие между этиленгликолем и полиэтиленгликолем состоит в том, что этиленгликоль имеет фиксированное значение молекулярной массы, тогда как полиэтиленгликоль не имеет фиксированного значения молекулярной массы.
Основные зоны покрытия
1. Что такое этиленгликоль
— Определение, свойства, использование
2. Что такое полиэтиленгликоль
— Определение, производство, использование
3. В чем разница между этиленгликолем и полиэтиленгликолем
— Сравнение основных отличий
Ключевые термины: этиленгликоль, водородные связи, полидисперсность, полиэтиленгликоль, полимеризация
Что такое этиленгликоль
Этиленгликоль представляет собой бесцветное спиртовое соединение без запаха, имеющее химическую формулу C 2 H 6 O 2 .Молярная масса этого соединения составляет около 62,07 г / моль. При комнатной температуре и давлении этиленгликоль представляет собой сиропообразную жидкость. Это вязкая жидкость. Температура кипения этой жидкости составляет около 198 ° C.
Рисунок 1: Химическая структура этиленгликоля
Этиленгликоль состоит из двух групп –OH в своей структуре. Следовательно, эта молекула способна образовывать водородные связи с молекулами воды. Следовательно, этиленгликоль смешивается с водой. Две группы –OH присоединены к соседним атомам углерода.
Этиленгликоль — сладкая сиропообразная жидкость. Наиболее распространенные применения этиленгликоля включают его использование в качестве сырья для производства полиэфирных волокон и в качестве автомобильного антифриза. Автомобильный антифриз — это жидкость, используемая в радиаторе и системе охлаждения двигателя внутреннего сгорания для транспортных средств. Однако это умеренно токсичное соединение.
Что такое полиэтиленгликоль
Полиэтиленгликоль представляет собой соединение простого полиэфира. Общая формула этого соединения представлена как H- (O-CH 2 -CH 2 ) n -OH.Молекулярная масса соединения варьируется в зависимости от значения «n» в этой общей формуле.
Рисунок 2: Молекулярная формула полиэтиленгликоля
Производство полиэтиленгликоля может осуществляться путем реакции между оксидом этилена и водой, этиленгликолем или олигомерами этиленгликоля. Для этой реакции нужен кислотный или основной катализатор. Когда вода используется для реакции с этиленоксидом, конечный продукт имеет высокую полидисперсность (продукт имеет высокое молекулярно-массовое распределение).Таким образом, конечный продукт дает множество полимерных соединений с разной молекулярной массой. Но если вместо воды использовать этиленгликоль или олигомеры, получается конечный продукт с низкой полидисперсностью.
Тип полимеризации зависит от типа катализатора. Это может быть катионная полимеризация или анионная полимеризация. Однако анионная полимеризация дает низкую полидисперсность. Поэтому так предпочтительнее. Кроме того, можно использовать суспензионную полимеризацию.
Полиэтиленгликоль имеет множество применений, включая медицинские, химические, биологические, промышленные и т. Д. Например, он используется в качестве наполнителя во многих фармацевтических продуктах.
Разница между этиленгликолем и полиэтиленгликолем
Определение
Этиленгликоль: Этиленгликоль представляет собой бесцветное спиртовое соединение без запаха, имеющее химическую формулу C 2 H 6 O 2 .
Полиэтиленгликоль: Полиэтиленгликоль представляет собой соединение простого полиэфира, что означает, что он имеет много эфирных групп.
Общая формула
Этиленгликоль: Общая формула этиленгликоля: C 2 H 6 O 2 .
Полиэтиленгликоль: Общая формула полиэтиленгликоля: H- (O-CH 2 -CH 2 ) n -OH.
Производство
Этиленгликоль: Этиленгликоль получают в результате реакции между оксидом этилена и водой.
Полиэтиленгликоль: Полиэтиленгликоль получают в результате реакции между этиленоксидом и водой, этиленгликолем или олигомерами этиленгликоля.
Молекулярный вес
Этиленгликоль: Молекулярная масса этиленгликоля составляет около 62,07 г / моль.
Полиэтиленгликоль: Молекулярная масса полиэтиленгликоля зависит от значения «n» в его общей формуле.
использует
Этиленгликоль: Этиленгликоль в основном используется для производства полиэфирных волокон и в качестве автомобильного антифриза.
Полиэтиленгликоль: Полиэтиленгликоль имеет множество применений, включая медицинские, химические, биологические, промышленные и т. Д.
Заключение
И этиленгликоль, и полиэтиленгликоль имеют большое коммерческое значение и используются во многих областях. Этиленгликоль представляет собой сиропообразную жидкость при комнатной температуре, а полиэтиленгликоль — твердый материал. Основное различие между этиленгликолем и полиэтиленгликолем состоит в том, что этиленгликоль имеет фиксированное значение молекулярной массы, тогда как полиэтиленгликоль не имеет фиксированного значения молекулярной массы.
Артикул:
1.Уэйд, Лерой Г. «Этиленгликоль». Encyclopdia Britannica, Encyclop incdia Britannica, inc., 2 декабря 2011 г., доступно здесь.
2. «ЭТИЛЕНГЛИКОЛЬ.» Национальный центр биотехнологической информации. База данных PubChem Compound, Национальная медицинская библиотека США, доступна здесь.
Изображение предоставлено:
1. «Этиленгликоль» Сандера де Йонга — собственная работа (общественное достояние) через Commons Wikimedia
2. «Полиэтиленгликоль» Клауса Хоффмайера — собственная работа, общественное достояние) через Commons Wikimedia
этиленгликоль
Этиленгликоль ( моноэтиленгликоль ( MEG ), название IUPAC: этан-1,2-диол ) представляет собой спирт с двумя -ОН-группами (диол), химическое соединение, широко используемое как автомобильный антифриз.В чистом виде это сиропообразная жидкость без запаха, цвета и сладкого вкуса. Этиленгликоль токсичен, и его случайное проглатывание следует рассматривать как неотложную медицинскую помощь. Рекомендуемые дополнительные знанияПроизводствоЭтиленгликоль получают из этилена через промежуточный оксид этилена. Оксид этилена реагирует с водой с образованием этиленгликоля в соответствии с химическим уравнением
Эта реакция может катализироваться кислотами или основаниями или протекать при нейтральном pH и повышенных температурах.Самый высокий выход этиленгликоля происходит при кислом или нейтральном pH с большим избытком воды. В этих условиях выход этиленгликоля составляет 90%. Основными побочными продуктами являются олигомеры этиленгликоля диэтиленгликоль, триэтиленгликоль и тетраэтиленгликоль. Эта молекула наблюдалась в космосе Холлисом и др. [2] используетОхлаждающая жидкостьВ основном этиленгликоль используется в качестве охлаждающей жидкости или антифриза, например, в автомобилях и персональных компьютерах.Благодаря низкой температуре замерзания он также используется в качестве противообледенительной жидкости для лобовых стекол и самолетов. Этиленгликоль также обычно используется в системах кондиционирования воздуха с охлажденной водой, в которых чиллер или кондиционеры размещаются снаружи, или в системах, которые должны охлаждаться ниже температуры замерзания воды. ПроизводствоЭтиленгликоль становится все более важным в пластмассовой промышленности для производства полиэфирных волокон и смол, включая полиэтилентерефталат, который используется для изготовления пластиковых бутылок для безалкогольных напитков.Антифризные свойства этиленгликоля сделали его важным компонентом витрификационных смесей для низкотемпературной консервации биологических тканей и органов. Незначительное использование этиленгликоля включает производство конденсаторов, в качестве промежуточного химического соединения при производстве 1,4-диоксана и в качестве добавки для предотвращения коррозии в системах жидкостного охлаждения для персональных компьютеров. ХимияЭтиленгликоль также можно использовать в качестве защитной группы для карбонильных групп в органическом синтезе.Взаимодействие кетона или альдегида с этиленгликолем с кислотным катализатором (например, п-толуолсульфоновой кислотой; BF 3 · Et 2 O) дает циклический ацеталь — 1,3-диоксолан, устойчивый к основанию и другие нуклеофилы. После этого защитную группу 1,3-диоксолана можно удалить, например, путем дальнейшего кислотного гидролиза. [3] В этом примере изофорон был защищен с помощью этиленгликоля п-толуолсульфоновой кислотой с умеренным выходом. Воду удаляли азеотропной перегонкой, чтобы сместить равновесие вправо. [4] Использование в лабораторияхЭтиленгликоль обычно используется в лабораториях для осаждения белков в растворе. Часто это промежуточный этап фракционирования, очистки и / или кристаллизации. Его можно использовать для защиты функциональных групп от реакции во время органического синтеза. Чтобы вернуть функциональной группе исходный состав, просто добавьте воду и кислоту. Этиленгликоль обычно используется в качестве консерванта для образцов в школах, часто во время вскрытия.Говорят, что он безопаснее формальдегида, но безопасность сомнительна. Другие приложенияЭтиленгликоль с высокой температурой кипения и сродством к воде делает его идеальным осушителем для производства природного газа. В полевых условиях избыток водяного пара обычно удаляется дегидратацией гликоля. Этиленгликоль стекает сверху вниз и встречает снизу поднимающуюся смесь водяного пара и углеводородных газов. Гликоль химически удаляет водяной пар, позволяя сухому газу выходить из верхней части башни.Гликоль и вода разделяются, и гликоль снова проходит через башню. Вместо удаления воды можно также использовать этиленгликоль для снижения температуры, при которой образуются гидраты. Чистота гликоля, используемого для подавления гидратов (моноэтиленгликоль), обычно составляет около 80%, тогда как чистота гликоля, используемого для дегидратации (триэтиленгликоль), обычно составляет 95-99 +%. Более того, скорость закачки для подавления гидратов намного ниже, чем скорость циркуляции в башне дегидратации гликоля. Этиленгликоль также используется в производстве некоторых вакцин, но сам по себе не присутствует в этих инъекциях. Он используется в качестве незначительного (1-2%) ингредиента в креме для обуви, а также в некоторых чернилах и красителях. ТоксичностьОсновная опасность этиленгликоля заключается в приеме внутрь. Из-за его сладкого вкуса дети и животные иногда потребляют его в больших количествах, если им есть доступ к антифризу. Этиленгликоль также может быть обнаружен в качестве загрязнителя в самогоне, подвергнутом дистилляции с использованием неправильно промытого автомобильного радиатора. В развитых странах горький агент, называемый бензоат денатония / денатония, обычно добавляют к препаратам этиленгликоля в качестве противодействующего вещества (для предотвращения случайного проглатывания).Если кто-то проглотил этиленгликоль, дайте ему алкогольный напиток, пока прибудут медработники. Этанол действует как конкурентный ингибитор активного центра фермента, который превращает этиленгликоль в его токсичные метаболиты. После связывания этанола этиленгликоль безвредно выводится из организма. Отравление этиленгликолем требует неотложной медицинской помощи, и в любом случае следует обращаться в токсикологический центр или обращаться за медицинской помощью. Он очень токсичен, его LD 100 для человека составляет примерно 1.4 мл / кг. [5] Однако даже 30 миллилитров (2 столовые ложки) могут быть смертельными для взрослых. [6] СимптомыСимптомы отравления этиленгликолем обычно развиваются в три этапа, хотя у отравленных людей не всегда будет развиваться каждая стадия или следовать определенным временным рамкам. [5] Стадия 1 состоит из неврологических симптомов, включая появление у жертв интоксикации, проявление таких симптомов, как головокружение, головные боли, невнятная речь и спутанность сознания.Со временем организм превращает этиленгликоль в другие токсины, сначала в гликолевый альдегид, который затем окисляется до гликолевой кислоты, глиоксиловой кислоты и, наконец, щавелевой кислоты. Стадия 2 является результатом накопления этих метаболитов и состоит из тахикардии, гипертонии, гипервентиляции и метаболического ацидоза. 3 стадия отравления этиленгликолем — результат повреждения почек, приводящий к острой почечной недостаточности. [7] Щавелевая кислота реагирует с кальцием и образует кристаллы оксалата кальция в почках. ЛечениеПервоначальное лечение состоит из стабилизации состояния пациента и деконтаминации желудка. Поскольку этиленгликоль быстро всасывается, обеззараживание желудка необходимо проводить вскоре после приема внутрь. Промывание желудка или назогастральная аспирация желудочного содержимого являются наиболее распространенными методами, применяемыми при отравлении этиленгликолем. Рвота, вызванная Ipecac, или активированный уголь (уголь не адсорбирует гликоли) не рекомендуются. [5] Противоядиями при отравлении этиленгликолем являются этанол или фомепизол; антидотное лечение составляет основу лечения после приема внутрь.Этанол (обычно вводимый внутривенно в виде 5 или 10% раствора в 5% растворе декстрозы и воды, но иногда также принимаемый в виде крепких спиртных напитков, таких как виски, водка или джин) действует, конкурируя с этиленгликолем за фермент алкогольдегидрогеназу. тем самым ограничивая образование токсичных метаболитов. Фомепизол действует, ингибируя алкогольдегидрогеназу, тем самым блокируя образование токсичных метаболитов. [8] Помимо антидотов, гемодиализ также может использоваться для ускорения удаления неметаболизированного этиленгликоля, а также его метаболитов из организма.Гемодиализ также имеет дополнительное преимущество в коррекции других метаболических нарушений или поддержке ухудшающейся функции почек, вызванной приемом этиленгликоля. Часто при лечении отравлений одновременно используются и антидотные препараты, и гемодиализ. Промышленные опасностиЭтиленгликоль может начать разлагаться при температуре 230–250 ° F (110–121 ° C). Обратите внимание, что выход из строя может произойти, когда объемная (средняя) температура системы ниже этих пределов, поскольку температура поверхности в теплообменниках и котлах может быть локально значительно выше этих температур. Электролиз растворов этиленгликоля с серебряным анодом приводит к экзотермической реакции. Катастрофа пожара Аполлона-1 была вызвана этой реакцией. Смесь этиленгликоль-вода воспламенялась и могла гореть в атмосфере чистого кислорода низкого давления. [ требуется ссылка ] ИсторияЭтиленгликоль был впервые получен в 1859 году французским химиком Шарлем-Адольфом Вюрцем. Он производился в небольших количествах во время Первой мировой войны как охлаждающая жидкость и как ингредиент взрывчатых веществ.Широкое промышленное производство началось в 1937 году, когда окись этилена, компонент в его синтезе, стала дешевой. При первом введении он произвел небольшую революцию в конструкции самолетов, поскольку при использовании вместо воды в качестве охлаждающей жидкости двигателя его более высокая точка кипения позволяла использовать радиаторы меньшего размера, работающие при более высоких температурах. До того, как этиленгликоль стал широко доступным, многие производители самолетов пытались использовать системы испарительного охлаждения, в которых использовалась вода под высоким давлением. Брент Дж., Макмартин К., Филлипс С., Буркхарт К., Донован Дж., Уэллс М., Кулиг К. (1999). «Фомепизол для лечения отравления этиленгликолем. Метилпиразол для группы изучения токсичных спиртов». N Engl J Med 340 (11): 832-8. PMID 10080845. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Моноэтиленгликоль | (Ch3OH) 2
Моноэтиленгликоль (также известный как MEG, EG, 1,2-этандиол или 1,2-дигидроксиэтан) представляет собой органическое соединение с формулой C 2 H 6 O 2 .Это слегка вязкая жидкость, прозрачная, бесцветная, со сладким вкусом и практически без запаха. Он смешивается с водой, спиртами и многими другими органическими соединениями и в основном используется в промышленности для производства полиэфирных волокон и в качестве компонента при производстве антифризов, охлаждающих жидкостей, антиобледенителей для самолетов и противообледенителей.
Технические характеристики
Химические и физические свойства моноэтиленгликоля:
Молекулярная формула: C 2 H 6 O 2 / (CH 2 OH) 2 / HOCH 2 CH 2 OH
Синонимы: моноэтиленгликоль, моноэтилгликоль, меггликоль, этиленгликоль, 1,2-этандиол, этан-1,2-диол, EG, технический гликоль, 1,2-дигидроксиэтан, гликолевый спирт.
Cas Номер: 107-21-1
Молекулярная масса: 62,07 г / моль
Точная масса: 62,036779 г / моль
Температура вспышки: 232 ° F / 111,11 ° C
Точка кипения: 387,7 ° F / 197,6 ° C при 760 мм рт. Ст.
Точка плавления: 9 ° F / -12,8 ° C
Давление пара: 0,06 мм рт. Ст. При 20 ° C / 68 ° F
Растворимость в воде: смешивается
Плотность: 1,115 при 68 ° F
Как производится?
Моноэтиленгликоль получают в промышленных масштабах из окиси этилена путем гидролиза.Оксид этилена получают путем окисления и затем подвергают взаимодействию с водой с образованием моноэтиленгликоля с ди- и триэтиленгликолями в качестве побочных продуктов:
C 2 H 4 O + H 2 O → HOCH 2 CH 2 OH
Моноэтиленгликоль также производится путем гидрирования диметилоксалата в присутствии медного катализатора или путем ацетоксилирования этилена.
Обработка, хранение и распространение
Опасности и токсичность
Моноэтиленгликоль имеет оценку 2 по NFPA, что указывает на то, что чрезмерное воздействие на кожу и глаза может вызвать раздражение и остаточные повреждения.Вдыхание паров не считается опасным; однако потребление жидкой формы может привести к травмам. Он имеет рейтинг воспламеняемости 1, что указывает на то, что для возникновения воспламенения требуется достаточный предварительный нагрев. Рейтинг нестабильности 0 предполагает, что моноэтиленгликоль обычно стабилен. Пары моноэтиленгликоля тяжелее воздуха и разносятся по окрестностям.
Безопасность и отзывы
При попадании в глаза немедленно промойте большим количеством воды и обратитесь за медицинской помощью.Если кожа загрязнена, снимите всю мокрую одежду и промойте кожу водой. В случае чрезмерного вдыхания дышите свежим воздухом и обратитесь за медицинской помощью. Для тушения пожаров следует использовать спиртоустойчивую пену или водное распыление, а также не допускать попадания разливов в источники воды и канализацию. При работе с моноэтиленгликолем необходимо использовать соответствующие средства индивидуальной защиты для защиты кожи и глаз.
Хранение и распространение
Моноэтиленгликоль
можно хранить в бочках из нержавеющей стали, алюминия или с футеровкой, в цистернах или автоцистернах.Он имеет удельный вес 1,115 и температуру вспышки 110 ° C (в закрытом тигле). Транспортировка по автомобильному, железнодорожному, воздушному или морскому транспорту не регулируется, но классифицируется как вредная и вредна при проглатывании.
Какой моноэтиленгликоль используется в
Промышленность использует
Основное применение моноэтиленгликоля в промышленности — это антифризы, где он является компонентом при производстве антифризов, охлаждающих жидкостей, антиобледенителей для самолетов и антиобледенителей из-за его способности снижать температуру замерзания воды.Он также используется в гидравлических тормозных жидкостях и системах охлаждения, таких как автомобили и кондиционеры, поскольку он действует как охлаждающая жидкость и теплоноситель.
В индустрии пластмасс существует большой спрос на моноэтиленгликоль, поскольку он является жизненно важным ингредиентом при производстве полиэфирных волокон, пленок и смол, одним из которых является полиэтилентерефталат (ПЭТ). Затем ПЭТ превращается в пластиковые бутылки, которые используются во всем мире. Подсчитано, что 70-80% всего потребляемого МЭГ используется в качестве промежуточного химического соединения в этих процессах производства полиэфиров.
Моноэтиленгликоль также используется в качестве растворителя в красках и электролитических конденсаторах, в качестве осушителя в газопроводах для предотвращения образования клатратов, в качестве промежуточного химического соединения при производстве конденсаторов, в качестве промышленного увлажнителя в волокнах, клеях, целлофане и т. Д. синтетические воски. Он также содержится в других промышленных продуктах, таких как пластификаторы, технологические добавки, адгезивы, добавки и средства для обработки поверхности.
Потребительские ресурсы
Моноэтиленгликоль содержится во многих потребительских товарах, таких как антифризы, антиобледенители, антиобледенители, тормозные жидкости, клеи, средства ухода за автомобилем, косметика, тонеры, ткани, чернила, ручки, краски, пластмассы и покрытия.
CDC — База данных по безопасности и охране здоровья при чрезвычайных ситуациях: Системный агент: ЭТИЛЕНГЛИКОЛЬ
AIR MATRIX
Bost RO, Sunshine I [1980]. Анализ этиленгликоля методом газовой хроматографии. J. Anal Toxicol 4 (2): 102-103.
Цао XL, Чжу Дж. [2001]. Метод контроля содержания глимов в воздухе и его применение при измерении выбросов выхлопных газов. Chemosphere 45 (6-7): 911-917.
NIOSH [1996]. NMAM 5523, выпуск 1: Гликоли. В кн .: Руководство по аналитическим методам НИОШ. 4-е изд. Цинциннати, Огайо: У.S. Министерство здравоохранения и социальных служб, Служба общественного здравоохранения, Центры по контролю и профилактике заболеваний, Национальный институт охраны труда и здоровья, Публикация DHHS (NIOSH) № 94-113.
Пендерграсс С.М. [1999]. Определение гликолей в воздухе: разработка методологии отбора проб и анализа и применение к театральным дымам. Am Ind Hyg Assoc J 60: 452-457.
Поттер В. [1999]. Этиленгликоль Метод PV2024. OSHA Солт-Лейк-Сити, Юта: Министерство труда США, Технический центр OSHA в Солт-Лейк-Сити, группа хроматографии.
ВОДА
Houz? P, Chaussard J [1993]. Одновременное определение этиленгликоля, пропиленгликоля, 1,3-бутиленгликоля и 2,3-бутиленгликоля в сыворотке крови и моче человека методом газовой хроматографии на широкополосной колонке. J Chromatogr B: Biomed Appl 619 (2): 251-257.
Kenyon AS, Shi X, Wang Y, Ng WH, Prestridge R, Sharp K [1998]. Простое обнаружение примесей диэтиленгликоля / этиленгликоля в глицерине и сырье на основе глицерина на месте с помощью тонкослойной хроматографии. J AOAC Int 81 (1): 44-50.
Маурер Х. Х., Петерс Ф. Т., Пол Л. Д., Кремер Т. [2001]. Утвержденный газовый хроматографо-масс-спектрометрический анализ для определения антифризов этиленгликоля и диэтиленгликоля в плазме крови человека после пивалилирования с помощью микроволнового излучения. J Chromatogr B: Biomed Appl 754 (2): 401-409.
Нильссон Л., Джонс А.В. [1992]. 2,3-Бутандиол: вещество, потенциально мешающее при анализе этиленгликоля ферментативным методом. Clin Chim Acta 208 (3): 225-229.
Oudhoff KA, Schoenmakers PJ, Kok W.T. [2003].Характеристика полиэтиленгликолей и полипропиленгликолей методами капиллярного зонного электрофореза и мицеллярной электрокинетической хроматографии. J Chromatogr A 985 (1-2): 479-491.
Шимански А., Вырвас Б., Шимановска М., Лукашевский З. [2001]. Определение короткоцепочечных полиэтиленгликолей и этиленгликоля в пробах окружающей среды. Water Res 35 (15): 3599-3604.
Валь А., Азаруаль Н., Имбенотт М., Матье Д., Форзи Дж., Картиньи Б., Вермеерш Дж., Лермитт М. [1998]. Отравление метанолом и этиленгликолем: спектроскопия ЯМР 1H как эффективный клинический инструмент для диагностики и количественной оценки.Токсикология 128 (1): 73-81.
Этиленгликоль — молекула месяца
Этиленгликоль — молекула месяца — июнь 2018 г. (HTML-версия)
Это же антифриз, не так ли?
Да, это одно из основных применений этиленгликоля (второе — производство полимеров).
Почему этиленгликоль используется в антифризах?
Понижает точку замерзания воды (и повышает точку кипения), а также смешивается с водой во всех пропорциях.И это связано со свойствами молекулы, особенно с ее способностью образовывать водородные связи.
Почему?Во-первых, этиленгликоль содержит полярные группы O-H; они полярны, потому что кислород намного более электроотрицателен, чем водород, поэтому он имеет тенденцию поляризовать электронную пару в связи O-H по отношению к нему. Это, в свою очередь, заставляет кислород нести частичный отрицательный заряд (δ-), а водород — частичный положительный заряд (δ +). Поскольку противоположные заряды притягиваются друг к другу, это означает, что молекулы этиленгликоля притягиваются друг к другу, что затрудняет их разъединение (вспомните о «молекулярной липучке»), а это, в свою очередь, делает его точку кипения выше, чем у углеводородов аналогичная масса. |
|
Водородная связь в этиленгликоле.
Поскольку этиленгликоль имеет две группы –ОН, каждая из которых может образовывать водородные связи, по сравнению с одной в другой двухуглеродной молекуле, этаноле («спирте»), вот почему температура кипения этиленгликоля довольно высока. выше, чем у этанола.
| Этиленгликоль | этанол |
Увеличенное количество водородных связей в этиленгликоле делает его более вязким (менее текучим), чем этанол (или вода).
Вода также, конечно же, содержит группы O-H, которые «связывают водородные связи» друг с другом, в результате чего вода имеет очень высокую температуру кипения для молекулы такого размера. Таким образом, молекулы этиленгликоля и воды могут образовывать водородные связи друг с другом, как и отдельные молекулы, что означает, что они свободно смешиваются во всех пропорциях, как показано на диаграмме ниже.
Как это помогает с антифризом?
Ну, этиленгликоль мешает сети водородных связей в чистой воде. Вода замерзает при 0 ° C, а чистый этиленгликоль при -12 ° C, но их смесь замерзает при гораздо более низкой температуре — самой низкой температуре кипения. достигается -55 ° C в смесях, содержащих 70% этиленгликоля. Это означает, что если такую смесь использовать в системе охлаждения автомобиля, она не затвердеет даже при очень низких зимних температурах.Это свойство также используется в противообледенительной жидкости на лобовых стеклах или внешних поверхностях самолетов.
Как вы производите этиленгликоль?
Обычно маршруты начинаются с этена (MOTM, декабрь 2006 г.). Впервые об этом сообщил в 1856 году Адольф Вюрц (изображение справа), французский химик из Эльзаса.
Эльзасец, вы имеете в виду, что он лаял?
Очень далеко от этого. Нет, он приехал из Эльзаса; вот почему в Страсбурге стоит его статуя.Он был большим сторонником теории атома. Во всяком случае, вернемся к гликолю. Он прореагировал 1,2-дийодэтан (косвенно полученный из этена) в реакции этерификации с этаноатом серебра (ацетатом), что также является реакцией нуклеофильного замещения. Затем полученный сложный эфир гидролизовали гидроксидом калия.
В настоящее время в промышленном производстве используются процессы, включающие гидратацию этиленоксида, легкодоступного химического вещества, получаемого из этена, в свою очередь получаемого крекингом алканов.Этот процесс восходит к открытию, о котором Вюрц сообщил в 1859 году.
А он пригодится при изготовлении полимеров?
Да, он используется в качестве одного из двух исходных материалов, используемых при производстве полиэтилентерефталата (ПЭТ, он же Дакрон и Терилен , символ вторичной переработки «1»). Двухосновная терефталевая кислота (бензол-1,4-дикарбоновая кислота) реагирует с диолэтиленгликолем, образуя сложный полиэфир.
Имеет множество применений, одно из которых — изготовление пластиковых бутылок для безалкогольных напитков (которые могут использоваться для неправильного хранения антифриза).Другие включают изоляцию и упаковку; веревки; ковры и одежда.
А прочее?
Ежегодно производится более 20 миллионов метрических тонн этиленгликоля. Его можно преобразовать в несколько других полезных химикатов, таких как глиоксаль, гликолевая кислота и метилгликолят, и другие применения продолжают развиваться, включая синтез наноматериалов.
Есть ли обратная сторона этиленгликоля?
Во-первых, он токсичен.
Почему?
В печени фермент алкогольдегидрогеназа превращает этиленгликоль сначала в гликоальдегид, а затем в другие токсичные молекулы. В конечном итоге щавелевая кислота выводит кальций из организма в виде нерастворимого оксалата кальция, который откладывается в почках и повреждает их, что приводит к почечной недостаточности. Также образуется метановая (муравьиная) кислота, которая может вызвать слепоту.
Кто особенно подвержен риску?
Поскольку антифриз — это обычное химическое вещество, некоторые люди небрежно обращаются с ним по дому.Они хранят его в контейнерах, предназначенных для других вещей, например, в контейнерах, предназначенных для напитков, и не имеют надлежащей маркировки. Люди оставляют его на гаражных полках, где его могут найти дети. Разливы не всегда устраняются. Это означает, что особенно подвержены риску домашние животные и маленькие дети. Одна ложка или около того может быть смертельной для кошки или маленькой собаки. Смертельная доза для взрослого человека составляет около 120 граммов. Антифриз обычно ярко окрашен, а этиленгликоль придает ему сладкий вкус, что делает его привлекательным для молодежи.В некоторых местах к нему добавляют горькое вещество, такое как бензоат денатония, чтобы отпугнуть людей, но некоторые исследования показали, что это не приносит успеха.
Так можно кого-нибудь антифризом отравиться?
Не говоря уже об отравлении, существует целый список людей, убитых антифризом. В 2007 году американка по имени Линн Тернер (на фото слева) была признана виновной в убийстве в 2001 году своего парня, полицейского Рэнди Томпсона, путем заливки антифриза в его желе.Таким же образом в 1995 году она убила своего тогдашнего мужа, пожарного Мориса Гленна Тернера. Г-жа Тернер была приговорена к пожизненному заключению и умерла в тюрьме в 2011 году от передозировки прописанных ей лекарств. В 2007 году женщина из Нью-Джерси по имени Мэриэнн Нибор была приговорена к 20 годам лишения свободы за убийство своего зятя, добавив этиленгликоль в свой коктейль из ананасового сока и вишни мараскино и приготовив «коктейль с антифризом». В январе 2008 года женщина из Сток-он-Трент (Великобритания) по имени Кейт Найт была признана виновной в попытке убить своего мужа Ли, добавив антифриз в его карри и красное вино, и приговорена к 30 годам лишения свободы.Хотя он выжил, у Ли была серьезная потеря зрения и слуха, а также сильно повреждены почки. Впоследствии он нашел любовь к медсестре по диализу Джеки Эванс, которая лечила его, и снова женился. В том же году Джеймс Кеун из Уолтэма, штат Массачусетс, был признан виновным в убийстве первой степени за то, что зашнуровал его жену Джулис Гаторэйд антифризом.
Затем в 2013 году онколог, специализирующийся на раке груди, доктор Ана Мария Гонсалес-Ангуло (фото справа), работавшая в онкологическом центре в Хьюстоне, штат Техас, добавила кофе своему возлюбленному доктору Джорджу Блюменшайну (легкие, голова и шея). онколог) с антифризом.Он прокомментировал сладкий вкус, но ему сказали, что это Splenda . Он выжил с повреждением почек. За нападение при отягчающих обстоятельствах она получила 10-летний срок. В 2016 году Дайан Стаудт и ее дочь Рэйчел из Спрингфилда, штат Миссури, были приговорены к пожизненному заключению после признания в убийстве сначала своего мужа Марка, а затем своего сына Шона антифризом. Затем по той же причине серьезно заболела ее старшая дочь Сара, но выжила.
Но следует помнить, что эти преступления очень редки; просто они, как правило, ловят заголовки.А пострадавшие расслабляются с антифризом. Постоянно.
Вы забыли футляр Cherry Lambrini
Ах да, спасибо. В 2013 году Жаклин Патрик добавила антифриз в напиток Cherry Lambrini своего мужа-водителя автобуса в Лондоне Дугласа на Рождество; она и ее дочь Кэтрин получили в общей сложности 18 лет лишения свободы. Она была поймана из-за орфографической ошибки («dignaty») в фальшивой предсмертной записке.
Разве я не видел что-нибудь об отравлении антифризом в «Побеге из тюрьмы»?
Да, в недавнем эпизоде сериала «Побег из тюрьмы» (сезон 5, эпизод 6, показан в мае 2017 года, если быть точным!), Главный герой Майкл Шофилд застрял в пустыне с джипом, но без воды, и около 20 миль пешком до безопасного места.И что еще хуже, он был ранен в ногу ножом, зараженным антифризом. Он благополучно добрался до дома, но ему потребовалась неотложная медицинская помощь от отравления, в том числе переливание крови!
Это единственное противоядие от отравления этиленгликолем?
Если врачи достаточно рано диагностируют отравление этиленгликолем, они могут назначить противоядие, например этанол. Он связывается с ферментом алкогольдегидрогеназа в печени примерно в 100 раз сильнее, чем этиленгликоль, так что, предотвращая прикрепление этиленгликоля к печени, почки имеют возможность вывести этиленгликоль в неизмененном виде и безвредно удалить его из организма. тело.Фомепизол (название которого происходит от химического названия 4-метилпиразол) — новый антидот, действующий так же, как этанол.
| Фомепизол |
Есть ли другие спирты, которые ведут себя аналогичным образом?
В антифризах обычно используются три разные молекулы: этиленгликоль, диэтиленгликоль (ДЭГ) и пропиленгликоль, особенно первая, которая вызывает большинство отравлений, случайных или иных.
| Этиленгликоль | Диэтиленгликоль (ДЭГ) | Пропиленгликоль |
Пропиленгликоль гораздо менее токсичен, но диэтиленгликоль был причастен к целому ряду отравлений. Как и этиленгликоль, он имеет очень высокую температуру кипения (244 ° C). Самый известный случай отравления диэтиленгликолем произошел в сентябре-октябре 1937 года, когда американская фармацевтическая компания хотела продать сульфаниламид (MOTM, июль 2011), чудесный, но несколько нерастворимый антибиотик, в жидкой форме.Их главный химик Гарольд Уоткинс обнаружил, что ДЭГ был очень хорошим растворителем для сульфаниламида. Он добавил красный цвет и аромат малины, и компания продавала его по США. К сожалению, он не проводил тестов на токсичность. Около сотни человек, многие из которых были детьми, умерли, прежде чем об этом стало известно. Уоткинс покончил жизнь самоубийством. Это привело к принятию Федерального закона о пищевых продуктах, лекарствах и косметических средствах 1938 года, который предоставил FDA право тестировать все новые лекарства, а 25 лет спустя этот закон запретил использование талидомида (MOTM, июль 2000 года) в США.
Статья из New York Times за 1985 год об австрийском винном скандале.
|
В 1985 году винная промышленность Австрии охватил скандал. Было обнаружено, что некоторые производители вина добавляли DEG в свои сладкие белые вина, чтобы они казались более сладкими, более похожими на Prädikatswein позднего урожая. Поскольку концентрации DEG были низкими, человеческих жертв не было, хотя винодельческая промышленность Австрии получила почти смертельный удар. В 1996 году 85 гаитянских детей умерли от фальсифицированного сиропа от кашля, содержащего ДЭГ, и эта же комбинация отравила более 300 детей в Бангладеш. Отхаркивающее средство, содержащее ДЭГ, было обвинено в смерти около 30 индийских детей в 1998 году. Другие случаи были зарегистрированы из таких стран, как Панама, Южная Африка, Нигерия и Аргентина. Еще в 2007 году были проблемы с некоторыми зубными пастами, импортируемыми из Китая, которые, как выяснилось, содержали DEG. Проблема сначала возникла в Панаме, но затем распространилась.Поддельная зубная паста Colgate , содержащая ДЭГ, была обнаружена в продаже в некоторых частях США, в то время как поддельная зубная паста Sensodyne была обнаружена в Англии. В какой-то момент FDA запретило производство всех зубных паст китайского производства из США. В период с 1 июня по 22 октября 2006 г. в Панаме произошло 119 случаев отравления ДЭГ, 78 из которых погибли из-за сиропа от кашля местного производства, не содержащего сахара. С другой стороны, другой триол, глицерин (MOTM, январь 2018 г.), совсем не токсичен, поскольку необходим для функционирования человеческого организма. |
У Эрнесто Осорио из Панамы было частично парализовано лицо после употребления сиропа от кашля, загрязненного ДЭГ. Фото: Анхель Франко / The New York Times |
| Глицерин Пропан-1,2,3-триол |
Небольшие изменения в структуре могут иметь большое значение для токсичности — просто подумайте о разнице между этанолом и гораздо более токсичным метанолом.
Библиография
- Chapman and Hall Combined Chemical Dictionary кодовый номер CTX90-I (этиленгликоль) и BGL75-B (диэтиленгликоль).
- A. Wurtz, «Sur le glycol or alcool diatomique», Comptes Rendus , 1856, 43 , 199-204 (открытие)
- A. Wurtz, «Synthèse du glycol avec l’oxyde d’éthylène et l’eau» Comptes rendus , 1859, 49 , 813–815.
- http://www.prepchem.com/synthesis-of-ethylene-glycol/ (лабораторный синтез)
- H. Yue, Y. Zhao, X. Ma и J. Gong, Chem. Soc. Ред. , 2012 г., 41 , 4218–4244 (обзор этиленгликоля)
- MA Jobson, SL Hogan, CS Maxwell, Y. Hu, GA Hladik, RJ Falk, MC Beuhler и WF Pendergraft, PLoS ONE , 2015, 10 , e0143044 (воздействие этиленгликоля в США и влияние горького добавки)
- К.Донг, С. Элангован, Р. Санг, А. Спанненберг, Р. Джекстелл, К. Юнг, Ю. Ли и М. Беллер, Nature Communications , 2016, 7 , 12075 (двухступенчатый синтез из CO)
- http://www.petresin.org/news_introtoPET.asp (информационный бюллетень по полиэтилентерефталату)
Случаи отравления
- J. A. Vale, B. Widdop и N. H. Bluett, Postgrad. Med. J. , 1976, 52 , 598-602 (отравление этиленгликолем у ребенка)
- А.Д. Уолдер и К. К. Г. Тайлер, Анестезия , 1994, 49 , 964-967 (3 случая отравления антифризом)
- I. Tennant, A. Crawford-Sykes, L. Ward и C. Thesiger, West Indian Med. J. , 2006, 55 , 286-287 (отравление после проглатывания тормозной жидкости)
- Б. В. Морган, Р. Дж. Геллер и З. Н. Каззи, West. J. Emerg. Med. , 2011, 12 , 296-299 (дело Линн Тернер и увеличение случаев умышленного отравления)
- Дж.Latus, M. Kimmel, M. D. Alscher и N. Braun, Clin. Kidney J. 2012, 5 , 120–123 (шесть случаев отравления этиленгликолем)
- Дело Линн Тернер
- Дело Джеймса Кеуна
- Дело Мэрианн Небор
- Чехол Lee Knight
- Дело Аны Марии Гонсалес – Ангуло
- Чехол Diane Staudte
Отравление вишневым ламбрини
Антидоты фомепизола и этанола
- Дж.Brent, Drugs , 2001, 61 , 979-988 (Управление отравлением этиленгликолем)
- R. Scalley, D. Ferguson, M. Smart and A. Thomas, Am. Fam. Врач , 2002, 66 , 807–812.
(лечение отравления этиленгликолем) - M. Battistella, Ann. Pharmacother ., 2002, 6 , 1085-1089
- Р. Д. Кокс и В. Дж. Филлипс, Военная медицина , 2004 г., 169 . 660-663.
- М. Ловрич, П. Гранич, М. Чебрило-Турек, З. Лалич и Й. Сертич, Forensic Science International , 2007, 170 , 213–215 (противоядие на основе этанола).
- J. Brent, New Engl. J. Med. , 2009, 360 , 2216-2223.
- К. Дж. Лепик, А. Р. Леви, Б. Г. Соболев, Р. А. Пурселл, К. Р. ДеВитт, Г. Д. Эрхард, Дж. Р. Кеннеди, Д. Э. Доус и Дж. Л. Бриньял, Ann. Emerg. Med. , 2009, 53 , 439–450.e10 (сравнение этанола и фомепизола)
Диэтиленгликоль (ДЭГ) и связанные с ним смертельные случаи
- E.М. К. Гейлинг и П. Р. Кэннон, JAMA . 1938, 111 , 919-926 (смерть от сульфаниламидного эликсира в США)
- М. Ханиф, М. Р. Мобарак, А. Ронан, Д. Рахман, Дж. Дж. Донован-младший и М. Бенниш,
BMJ , 1995, 311 , 88-91 (смертельные случаи в Бангладеш из-за ДЭГ в качестве растворителя в эликсире парацетамола) - R. Malebranche, C. Heckdivert, A. Lassegue, et al., Morb. Смертный. Wkly. Rep. 1996, 45 , 649–650. (погибшие на Гаити)
- К.Л. О’Брайен, Дж. Д. Селаникио, К. Хекдиверт, М. — Ф. Пласид, М. Луи, Д. Б. Барр, Дж. Р. Барр, Дж. Хоспедалес, М. Дж. Льюис, Б. Шварц, Р. М. Филен, С. Сент-Виктор, Дж. Эспиндола, Л. Л. Нидхэм и К. Денервилл, JAMA . 1998 г., 279 , 1175-1180 (погибло на Гаити)
- Т. Хагер, Демон под микроскопом: от больниц на поле боя до нацистских лабораторий, Героический поиск одного доктора для первого в мире чудодейственного препарата , Нью-Йорк, Гармония, (2006). (сульфаниламидный эликсир)
- Ф.Эрнандес, М. Ибаньес и Х. В. Санчо, Anal. Bioanal Chem. , 2008, 391 , 1021–1027 (обнаружение ДЭГ в зубной пасте)
- J. G. Schier, C. S. Rubin, D. Miller, D. Barr и M. A. McGeehin, Public Health Pol. , 2009, 30 , 127-143. (обзор отравлений ДЭГ)
- L. M. Besenhofer, M. C. McLaren, B. Latimer, M. Bartels, M. J. Filary, A. W. Perala и K. E. McMartin, Toxicological Sci. , 2011, 123 , 374–383 (механизм токсичности ДЭГ)
- Н.Willy (ed), 1985 Diethylene Glycol Wine Scandal , Culp Press, 2011.
- L. Conklin, JJ Sejvar, S. Kieszak, R. Sabogal, C. Sanchez, D. Flanders, F. Tulloch, G. Victoria, G. Rodriguez, N. Sosa, MA McGeehin и JG Schier, JAMA Intern . Med. , 2014, 174 , 912-917 (отдаленные почечные и неврологические исходы у выживших после отравления Панамским ДЭГ в 2006 г.)
- Н. Р. Соса, Г. М. Родригес, Дж. Г. Шиер и Дж. Дж. Сейвар, Annals of Emergency Medicine , 2014, 64 , 38-47 (особенности отравления ДЭГ в Панаме в 2006 г. плюс история массовых отравлений ДЭГ)
- Х.Камада, Х. Судзуки, С. Ямамото, Р. Номура и С. Кусимото, Acute Medicine & Surgery , 2017, 4 , 326–328 (восстановление после отравления DEG за 2-летний период)
Вернуться на страницу «Молекула месяца». [DOI: 10.6084 / m9.figshare.5611279]
Этиленгликоль — обзор
11.4.3 Механизм коррозии
Чистый этиленгликоль имеет очень низкую электропроводность и почти изолирует.В лаборатории было измерено, что удельное сопротивление чистого этиленгликоля примерно в 40 раз выше, чем у воды типа II по ASTM [27]. Следовательно, удельное сопротивление раствора этиленгликоля будет уменьшаться с увеличением содержания воды. Более того, разбавление водой способствует гидролизу гидроксильных групп этиленгликоля, что также приводит к увеличению проводимости. Измеренное в лаборатории удельное сопротивление 33 об.% Раствора этиленгликоля составляет около 10 4 Ом см [27], что намного выше, чем у обычного водного раствора (обычно менее 10 2 Ом см). .Следовательно, высокое сопротивление раствора играет важную роль в коррозии.
В растворе этиленгликоля коррозионные повреждения магния локализованы. Язвенная коррозия хорошо видна на поверхности [27], а окружающая область, где она не подверглась коррозии, относительно блестящая. Яма представляет собой активный анод, а окружающая его блестящая область представляет собой катод, защищенный от коррозии в результате точечной коррозии. На рисунке 11.5 схематично показана локальная питтинговая коррозия и соответствующая эквивалентная схема для магния в растворе этиленгликоля.В эквивалентной схеме C d — это емкость не корродированной области образца магния, R pt и C pt — сопротивление и емкость в нижней части корродирующего ( точечной коррозии), R ps — сопротивление раствора в яме, а R s — сопротивление раствора между электродом сравнения и образцом магния. Следовательно, общее сопротивление поляризации R p можно выразить как: R p = R ps + R pt .Из-за высокого удельного сопротивления раствора соотношение R ps к R pt очень велико ( R ps >> R pt ), и, следовательно, R pt. ≈ R пс .
11,5. Модель питтинга магния в растворе этиленгликоля и соответствующая схема замещения.
Локальное коррозионное повреждение означает, что скорость точечной коррозии ограничивается сопротивлением раствора в яме, и, таким образом, удельное сопротивление раствора может значительно влиять на коррозионную стойкость или сопротивление поляризации магния в растворе этиленгликоля.Вывод был подтвержден измеренной линейной зависимостью между сопротивлением поляризации и удельным сопротивлением раствора [27]; поскольку сопротивление раствора увеличивается с увеличением концентрации этиленгликоля, сопротивление поляризации также увеличивается. Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис. 11.2).
В загрязненном растворе этиленгликоля сопротивление раствора снижается с увеличением концентрации каждого загрязняющего вещества NaCl, Na 2 SO 4 или NaHCO 3 .Уменьшение поляризационного сопротивления магния можно объяснить повышенным общим содержанием ионов в растворе. При низком содержании загрязняющих веществ проводимость раствора пропорциональна концентрации электролитов. Снижение стойкости к растворам особенно заметно при увеличении концентрации NaCl. Это объясняет наиболее пагубное влияние NaCl на коррозионные характеристики магния в загрязненном растворе этиленгликоля.Уменьшение стойкости раствора, вызванное загрязнителями, также может объяснить небольшое увеличение скорости коррозии магния в этиленгликоле при добавлении Mg (OH) 2 и Mg (NO 3 ) 2 (рис. 11.3).
Помимо стойкости к раствору, наиболее фундаментальным объяснением коррозионного поведения магния в этиленгликоле может служить граница раздела магний / этиленгликоль. Как и большинство других органических веществ, этиленгликоль может адсорбироваться на поверхности электрода.Емкость C d является хорошим показателем адсорбции этиленгликоля на поверхности магния. Было измерено [27], что емкость уменьшается с увеличением концентрации этиленгликоля. Уменьшение емкости интерфейса может быть вызвано тем, что вода с высокой диэлектрической проницаемостью на границе раздела заменяется более длинными молекулами диэлектрика. Молекула этиленгликоля больше и менее полярна, чем вода. Его адсорбция на поверхности магния, безусловно, может привести к снижению C d .Когда концентрация этиленгликоля увеличивается, больше этиленгликоля будет адсорбироваться на поверхности, что приведет к снижению C d . Другими словами, поверхность магния более полно покрыта молекулами этиленгликоля в более концентрированном растворе этиленгликоля, который более эффективно защищает магний от воздействия воды. Это объясняет уменьшение скорости коррозии магния с увеличением концентрации этиленгликоля (рис. 11.2).
В загрязненном растворе NaCl, Na 2 SO 4 и NaHCO 3 меньше по размеру, чем этиленгликоль.Увеличение емкости должно быть связано с заменой этиленгликоля на поверхности магния загрязняющими веществами. SO 4 2- и HCO 3 — могут быть сильнее (легче) адсорбироваться на поверхности магния, чем Cl —. Дополнительный адсорбированный этиленгликоль может быть заменен на Na 2 SO 4 или NaHCO 3 , и в результате этого обмена получается более высокая поверхностная емкость, чем от NaCl при той же весовой / объемной концентрации этих загрязняющих веществ.Тем не менее хорошо известно, что хлориды намного более агрессивны, чем сульфаты и карбонаты. Достаточно всего нескольких адсорбированных ионов хлорида, чтобы значительно ускорить растворение магния на адсорбированных участках. Таким образом, скорость коррозии магния выше в хлоридсодержащем растворе этиленгликоля, чем в растворе этиленгликоля, содержащем Na 2 SO 4 или NaHCO 3 .
Более сильная адсорбция Na 2 SO 4 или NaHCO 3 , чем хлорид, означает, что если ионы Na 2 SO 4 или NaHCO 3 добавляются в хлоридсодержащий раствор этиленгликоля, адсорбированные ионы Cl — на поверхности магния будут заменены сульфатом или карбонатом.Поскольку сульфат или карбонат гораздо менее агрессивны для магния, чем хлорид, замена адсорбированных хлоридов сульфатами или карбонатами фактически пассивирует активные центры на поверхности магния. Следовательно, растворение магния замедляется. Следовательно, в хлоридсодержащем растворе Na 2 SO 4 или NaHCO 3 будут играть двойную роль. С одной стороны, ингибирующее действие Na 2 SO 4 или NaHCO 3 приводит к пассивации.С другой стороны, добавление Na 2 SO 4 или NaHCO 3 в хлоридсодержащий раствор этиленгликоля снижает стойкость раствора, что приводит к снижению коррозионной стойкости. После того, как большая часть адсорбированных ионов хлорида на поверхности магния отталкивается, дальнейшее добавление Na 2 SO 4 или NaHCO 3 может уменьшить только R s раствора. Следовательно, скорость коррозии магния сначала уменьшается, а затем увеличивается при дальнейшем добавлении Na 2 SO 4 или NaHCO 3 .
Что такое полиэтиленгликоль? | Sciencing
Полиэтиленгликоль (ПЭГ) производится из этиленгликоля (этан-1,2-диол), основного ингредиента антифриза. Когда этиленгликоль (молекулярная масса 62,07) полимеризуется, реагирует с самим собой (в воде), реакция дает множество продуктов, содержащих различное количество звеньев этиленгликоля. Все эти продукты называются ПЭГ. Общая молекулярная формула ПЭГ — H (OCh3Ch3) nOH, где n представляет собой количество звеньев этиленгликоля, содержащихся в полимере ПЭГ.ПЭГ используются во многих промышленных, пищевых и фармацевтических целях.
Типы ПЭГ
Молекулярные массы ПЭГ определяются числом единиц этиленгликоля, включенных в каждый полимер ПЭГ, и варьируются от 300 грамм на моль до 10 000 000 грамм на моль. Молекулярная масса, в свою очередь, определяет характеристики каждого типа или категории ПЭГ. ПЭГ с низким молекулярным весом, содержащие от двух до четырех единиц этиленгликоля на полимер, представляют собой прозрачные водянистые жидкости. ПЭГ, содержащие до 700 единиц этиленгликоля на полимерный продукт, представляют собой прозрачные густые жидкости.ПЭГ, содержащие 1000 или более единиц этиленгликоля на полимерный продукт, представляют собой воскообразные твердые вещества.
Характеристики ПЭГ
ПЭГ нетоксичны, не имеют запаха, цвета, раздражения и плохо испаряются. ПЭГ считаются инертными (они не вступают в реакцию с другими материалами) и нетоксичны. ПЭГ растворимы во многих органических растворителях. Все ПЭГ легко растворяются в воде и не меняют цвет, запах или вкус воды.
Применение полиэтиленгликоля в медицине
Характеристики полиэтиленгликоля делают его превосходным материалом для использования в фармацевтической промышленности.ПЭГ используются в качестве лубрикантов и используются в различных фармацевтических продуктах в качестве растворителей, дозирующих агентов, мазей, жидкостей для доставки лекарств, наполнителей для таблеток, в качестве основы для суппозиториев, в офтальмологических растворах и для лечения запоров. ПЭГ также используются в ветеринарных продуктах.
Промышленное использование PEGS
В производственных процессах PEGS используются в качестве покрытий на водной основе, средств защиты от пыли в сельскохозяйственных продуктах, осветлителей при гальванике, чистящих и моющих средств, увлажнителей в косметических продуктах, красителей для красок и чернил, упаковки продукты, антипригарные агенты для формованных изделий, стабилизаторы цвета для бумаги, производства керамики, смягчители и антистатики в текстильном производстве и флюсах для пайки.
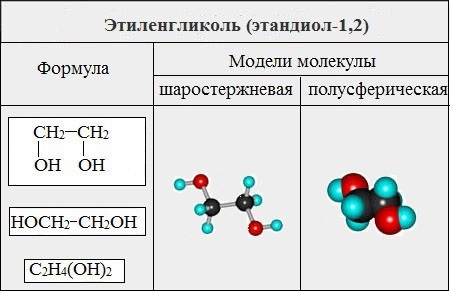 Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.
Полученный продукт снижает обводнение горючих смесей и повышает эффективность топлива для самолетов и вертолетов.
 Это второе основное применение;
Это второе основное применение;