Содержание
ХиМиК.ru — ГЛИКОЛИ — Химическая энциклопедия
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
ГЛИКОЛИ (алкандиолы), двухатомные спирты жирного ряда общей ф-лы
СnН2n(ОН)2. Группы ОН в молекулах могут
находиться у одного атома С (геминальные гликоли), у соседних атомов (вицинальные)
и т.д. Названия гликолей производят от названий соответствующих алканов или ал-кенов
и соотв. суффиксов «диол» или «гликоль», напр. НОСН2СН2ОН-1,2-этандиол
или этиленгликоль, НОСН2СН2СН2ОН-1,3-пропандиол
или 1,3-пропиленгликоль (триметиленгликоль).
Наиб, практич. значение имеют этиленгликоль, пропиленгликоли, бутиленгликоли
и нек-рые их производные, содержащие одну или более простых эфирных
групп в молекуле (т. н. полигликоли, напр. диэтиленгликолъ), высокомолекулярные
н. полигликоли, напр. диэтиленгликолъ), высокомолекулярные
полиэтиленгликоли (см. Полиэтиленоксид).
Низшие гликоли — бесцв. прозрачные вязкие жидкости (см. табл.) без запаха,
имеют сладковатый вкус, гигроскопичны. Наличие в молекуле двух групп ОН
обусловливает более высокие плотность, вязкость и т-ру кипения гликолей, чем
соответствующих одноатомных спиртов. Геминальные гликоли нестойки, напр. метиленгликоль
существует только в водных р-рах.
СВОЙСТВА ГЛИКОЛЕЙ
Низшие гликоли (С2-С7) смешиваются с водой, спиртами,
альдегидами, кетонами, к-тами, аминами во всех соотношениях. Гликоли, особенно
полигликоли, хорошо растворяют синтетич. смолы, лаки, краски, эфирные масла,
каучуки. Ароматич. углеводороды растворяются в гликолях ограниченно, предельные
алифатич. углеводороды не растворяются. Благодаря водородным связям гликоли
образуют ассоциаты с водой (гидраты), аминами и др. При образовании гидратов
значительно понижается т-ра замерзания водных р-ров гликолей.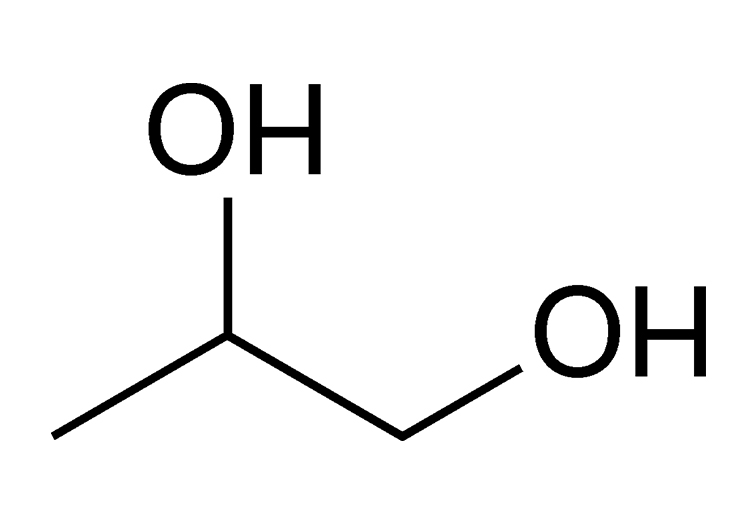 На этом св-ве основано
На этом св-ве основано
применение их как антифризов.
Гликоли обладают всеми хим. св-вами, характерными для спиртов. Гидроксильные
группы гликолей реагируют независимо друг от друга или одновременно (поэтому
иногда образуются соответствующие смеси продуктов). Со щелочными металлами
и их гидроксидами гликоли образуют гликоляты (напр., NaOCH2CH2ONa),
с одноосновными карбоновыми к-тами, их ангидридами или хлорангидридами
— сложные моно- и диэфиры, с двухосновными к-тами и их производными-линейные
сложные полиэфиры типа [—ORO—(O)CR’C(O)—]n, с низкомол. двухосновными
к-тами или их эфирами-циклич. соединения, напр.:
При действии галогеноводородов гликоли легко превращаются в галогенгидрины,
напр. при нагр. с НС1 1,2-пропиленгликоля образуется смесь С1СН2СН(ОН)СН3
и НОСН2СН(С1)СН3; однако вторая группа ОН замещается
на галоген труднее (лучше — действием РС15 или SOC12).
С альдегидами и кетонами (кат.-FеС13, Н3РО4)
гликоли дают циклич. ацетали (1,2-гликоль-1,3-диоксоланы, 1,3-гликоль-1,3-диоксаны), напр.:
Под действием щелочных катализаторов гликоли реагируют с ацетиленом с образованием
виниловых и дивиниловых эфиров: напр.:
с акрилонитрилом — моно- или бис-цианэтиловых эфиров, напр.:
с эпоксидами при 140-180 °С — ди-, три- и полигликолей, напр.:
Характер продуктов, образующихся при дегидратации гликолей, определяется взаимным
расположением групп ОН в молекуле и условиями р-ции. Так, под действием
ZnCl2, разб. H2SO4 при слабом нагревании
вициналопые гликоли превращаются в альдегиды или кетоны, напр.: НОСН2СН2ОН
-> СН3СНО, 1,2-пропиленгликоль в присут. Н3РО4
на цеолите при 250°С- в осн. в СН3СН2СНО, пипакопы
в результате пинаколиновой перегруппировки-в пинаколины. Гликоли (кроме
Гликоли (кроме
вицинальных) превращаются в ненасыщ. спирты или диены, напр.:
Кислородом гликоли окисляются до пероксидов, формальдегида, ацетона, муравьиной
к-ты, сложных эфиров и др.; действием К2Сr2О7
или КМnО4-до СО2 и Н2О. Осн. методы синтеза
гликолей:
Гликоли-р-рители, пластификаторы. Они применяются также для приготовления
антифризов и гидравлич. жидкостей (этилен- и пропиленгликоли), для синтеза
эфиров гликолей, полиэфирных смол, полиуретанов (1,2-пропиленгликоль, 1,4-бутиленгликоль),
увлажнения разл. продуктов, напр. табака, казеина, желатины.
Токсичность гликолей убывает с увеличением мол. массы.
===
Исп. литература для статьи «ГЛИКОЛИ»: ДыментО.Н., Казанский К.С., Мирошников А. М., Гликоли и
другие производные окисей этилена и пропилена, М., 1976; Kirk-Othmer encyclopedia,
2 ed. , v. 10, N.Y., 1966. Б. Б. Чесноков.
, v. 10, N.Y., 1966. Б. Б. Чесноков.
Страница «ГЛИКОЛИ» подготовлена по материалам химической энциклопедии.
А
Б
В
Г
Д
Е
Ж
З
И
К
Л
М
Н
О
П
Р
С
Т
У
Ф
Х
Ц
Ч
Ш
Щ
Э
Ю
Я
Еще по теме:
- ГЛИКОЛИ — химическая энциклопедия
ICSC 0305 — НЕОПЕНТИЛ ГЛИКОЛЬ
ICSC 0305 — НЕОПЕНТИЛ ГЛИКОЛЬ
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRGerman — DEHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| НЕОПЕНТИЛ ГЛИКОЛЬ | ICSC: 0305 (Март 2001) |
| CAS #: 126-30-7 |
| EINECS #: 204-781-0 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ |
Горючее. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси.
|
НЕ использовать открытый огонь. Замкнутая система, взрывозащищенное (для пыльной среды) электрическое оборудование и освещение. Не допускать оседания пыли. | Использовать распыленную воду, порошок. |
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
|---|---|---|---|
| Вдыхание | Кашель. | Избегать вдыхания пыли и тумана. Применять вентиляцию, местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. |
| Кожа | Покраснение. | Защитные перчатки. | Снять загрязненную одежду. Ополоснуть и затем промыть кожу водой с мылом. |
| Глаза |
Покраснение. Боль. Боль.
|
Использовать средства защиты глаз. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
| Индивидуальная защита: P2 фильтрующий респиратор с фильтром Р2 для защиты от вредных частиц. Смести просыпанное вещество в закрытые контейнеры. Удалить газ при помощи водного аэрозоля. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
Отдельно от окислителей.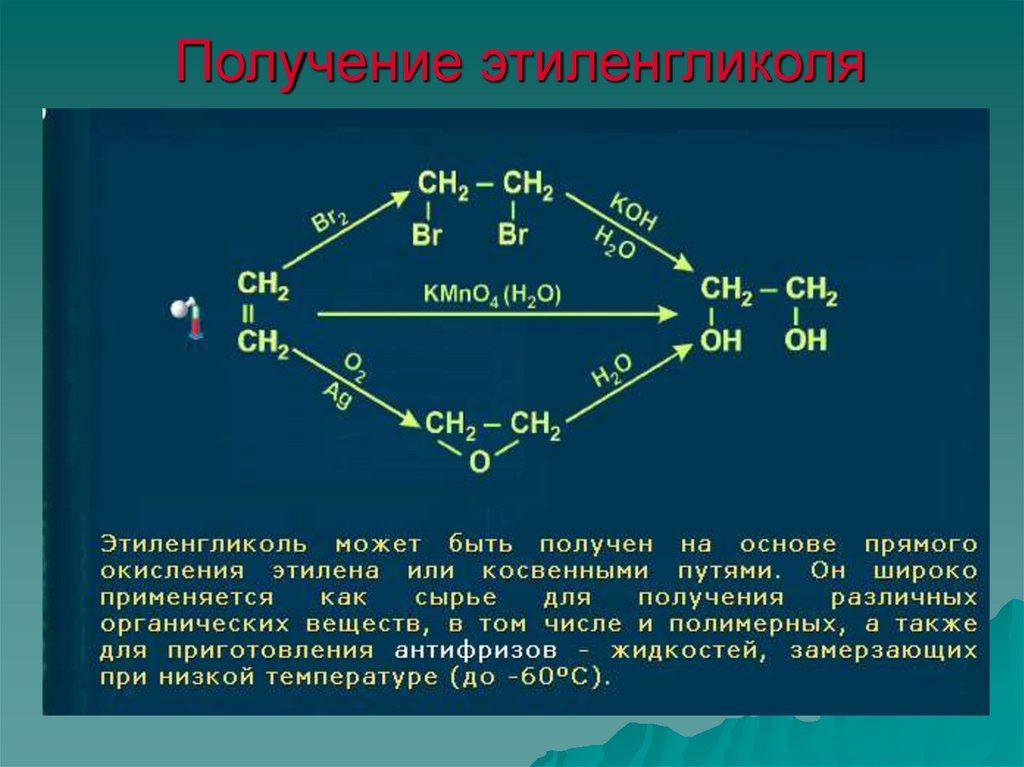 Хранить сухим. Хранить сухим.
|
|
| УПАКОВКА | |
| НЕОПЕНТИЛ ГЛИКОЛЬ | ICSC: 0305 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: C5H12O2 / (CH3)2C(CH2OH)2 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Медицинские эффекты воздействия вещества не исследованы должным образом. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) |
Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации. © Версия на русском языке, 2018 |
Пропиленгликоль | Описание, производство и использование
- Связанные темы:
- гликоль
См. все сопутствующие материалы →
пропиленгликоль , также называемый пропан-1,2-диол или 1,2-пропандиол , синтетическое органическое соединение с химической формулой C 3 H 8 O 2 90 . Пропиленгликоль представляет собой бесцветную относительно вязкую жидкость без запаха и слегка сладковатого вкуса. Он гигроскопичен, что означает, что он легко поглощает воду из окружающей среды. Годовое производство пропиленгликоля только в США превышает 450 тонн. Мировой спрос на пропиленгликоль оценивается примерно в 2 миллиона тонн в год; ожидается, что к 2035 году спрос вырастет почти до 4 млн тонн9.0009
Пропиленгликоль имеет молекулярную массу 76,09 грамма на моль, температуру кипения 187,6 °C (370,8 °F), точку плавления –60 °C (–76 °F) и плотность 1,0361 грамма на куб.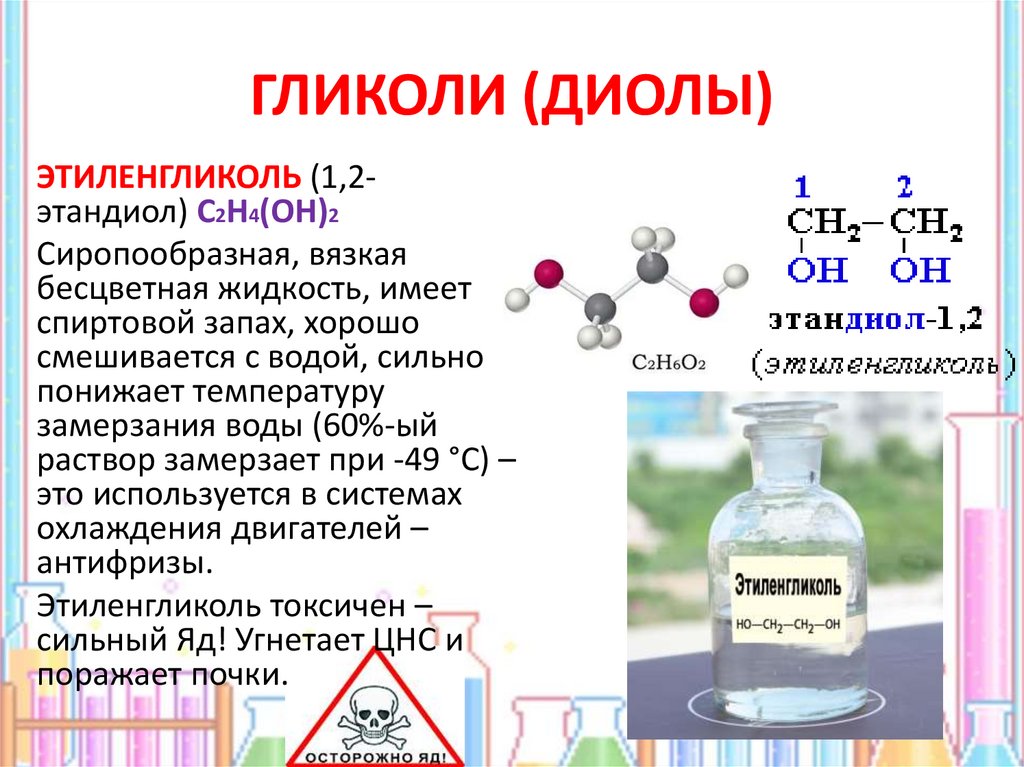 сантиметр при 20 ° C (68 ° F). Считается безопасным для употребления человеком; однако большие дозы в течение коротких периодов времени могут быть токсичными. В хорошо закрытом контейнере пропиленгликоль стабилен при более низких температурах. При более высоких температурах и в открытом контейнере он окисляется и производит различные химические вещества, в том числе молочную кислоту, пировиноградную кислоту и уксусную кислоту.
сантиметр при 20 ° C (68 ° F). Считается безопасным для употребления человеком; однако большие дозы в течение коротких периодов времени могут быть токсичными. В хорошо закрытом контейнере пропиленгликоль стабилен при более низких температурах. При более высоких температурах и в открытом контейнере он окисляется и производит различные химические вещества, в том числе молочную кислоту, пировиноградную кислоту и уксусную кислоту.
Пропиленгликоль реагирует с сильными окислителями, что может привести к пожару. Например, он реагирует с плавиковой кислотой (сильный окислитель), азотной кислотой и нитратом серебра с образованием гремучего серебра, чрезвычайно взрывоопасного соединения.
Производство
Пропиленгликоль может быть получен в промышленном производстве путем прямого гидролиза пропиленоксида водой. В качестве альтернативы можно использовать хлоргидриновый процесс или перекисное окисление; каждый из этих процессов начинается с мономера пропилена (также называемого пропеном, трехуглеродной цепью, которая содержит одну углерод-углеродную двойную связь). В обоих этих процессах образуется промежуточный продукт оксида пропилена, который затем подвергается реакции в процессе гидратации с образованием пропиленгликоля.
В обоих этих процессах образуется промежуточный продукт оксида пропилена, который затем подвергается реакции в процессе гидратации с образованием пропиленгликоля.
В 2001 году американские инженеры-химики Рэнди Кортрайт и Джеймс Дюмесик из Университета Висконсин-Мэдисон разработали процесс преобразования химических веществ на основе кукурузы в пропиленгликоль. Каталитический процесс эффективно превращал молочную кислоту, полученную из кукурузы, в пропиленгликоль. Этот процесс позволяет избежать использования химикатов на нефтяной основе, тем самым снижая стоимость производства пропиленгликоля.
Применение
В целом производство пропиленгликоля делится на три категории: пищевой, промышленный и технический. Большинство конечных применений пропиленгликоля существует в строительстве, за которым следуют транспорт, фармацевтика, косметика и производство химикатов для пищевых продуктов. Производство продуктов питания и напитков и косметическая промышленность составляют сектор с наибольшим ростом рынка его использования.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Пищевой
Пропиленгликоль используется в растворе для доставки многих внутривенных лекарств пациентам, в препаратах от кашля и в мазях для местного применения (например, кортикостероиды) для лечения определенных кожных заболеваний. Пропиленгликоль также используется в качестве пищевой добавки, а также в качестве эмульгатора, консерванта влаги, антиоксиданта, стабилизатора и средства, препятствующего слеживанию. Пропиленгликоль используется в некоторых электронных сигаретах, и из-за его гигроскопических свойств считается, что использование этого химического вещества является причиной того, что некоторые пользователи электронных сигарет жалуются на сухость во рту и горле. Хотя потребление пропиленгликоля считается безопасным, продолжаются исследования по изучению воздействия на организм человека вдыхания паров пропиленгликоля.
Промышленный сорт
Пропиленгликоль используется в жидкостях, которые регулируют вязкость, растворяют активные ингредиенты и останавливают коррозию металлов. Пропиленгликоль промышленного качества также используется в качестве исходного материала при производстве пластмасс и смол, которые используются для изготовления таких предметов, как корпуса лодок, автомобильные и электрические детали, а также лопасти, используемые на ветряных турбинах. Пропиленгликоль также используется в антифризах вместо этиленгликоля, так как он менее вреден для окружающей среды.
Пропиленгликоль промышленного качества также используется в качестве исходного материала при производстве пластмасс и смол, которые используются для изготовления таких предметов, как корпуса лодок, автомобильные и электрические детали, а также лопасти, используемые на ветряных турбинах. Пропиленгликоль также используется в антифризах вместо этиленгликоля, так как он менее вреден для окружающей среды.
Технический класс
Пропиленгликоль используется в качестве противогололедного реагента для самолетов и в качестве добавки к жидкости для омывания ветрового стекла в транспортных средствах. Он также используется в производстве гидравлических жидкостей, теплоносителей и жидких моющих средств. В качестве теплоносителя пропиленгликоль используется в системах отопления, вентиляции и кондиционирования воздуха (HVAC), в холодильных установках для катков и холодильных камерах. Он также является основным ингредиентом раствора для генераторов дыма, которые используются в театральных постановках, при обучении пожарных, на концертах и представлениях на Хэллоуин.
Кен Стюарт
Что такое диэтиленгликоль? | Поставщик химикатов
Диэтиленгликоль (также известный как ДЭГ, 2,2-оксидиэтанол и дигликоль) представляет собой прозрачную бесцветную жидкость без запаха с формулой C 4 H 10 O 3 . Он растворим как в воде, так и во многих органических соединениях и обладает гигроскопическими свойствами, что делает его полезным промышленным химикатом.
Технические свойства
Технические свойства диэтиленгликоля:
Номер Cas: 111-46-6
Молекулярная формула: C4h20O3 или (Ch3Ch3OH)2O
Синонимы: Дигликоль, ДЭГ, 2,2-оксидиэтанол и дигидроксидиэтиловый эфир
Молекулярная масса: 106,12 г/моль
Температура воспламенения
(открытый тигель): 143 °C (290 °F)
Температура самовоспламенения: 229 °C (444 °F)
Температура кипения: 245 °C (473 °F)
Температура плавления: -10 °C (14 °F)
Плотность: 1,12 при 20 °C (68 °F)
Log P: -1,47
Как производится?
Производство диэтиленгликоля обычно основано на спросе и производстве моноэтиленгликоля (МЭГ), поскольку он является побочным продуктом этого производственного процесса. Процесс заключается в окислении этилена при высокой температуре в присутствии катализатора на основе оксида серебра. Оксид этилена затем гидратируют с получением диэтиленгликоля с моноэтиленгликолем и триэтиленгликолем в качестве побочных продуктов.
Процесс заключается в окислении этилена при высокой температуре в присутствии катализатора на основе оксида серебра. Оксид этилена затем гидратируют с получением диэтиленгликоля с моноэтиленгликолем и триэтиленгликолем в качестве побочных продуктов.
Химическая промышленность пытается максимизировать производство моноэтиленгликоля в этом процессе, однако диэтиленгликоль является очень полезным побочным продуктом.
Как он хранится и распространяется?
Диэтиленгликоль можно хранить в бочках из нержавеющей стали, алюминия или с покрытием, в вагонах-цистернах или автоцистернах. Он имеет удельный вес 1,118 и температуру вспышки 143 ° C (открытый тигель). Это приводит к рейтингу воспламеняемости 1 в соответствии с NFPA 704, что указывает на то, что соединение требует значительного предварительного нагрева, прежде чем может произойти воспламенение. Он не регулируется для перевозки автомобильным, железнодорожным, воздушным или морским транспортом, но классифицируется как вредный и может быть токсичным при проглатывании.
Опасность для здоровья
Соединение имеет рейтинг 1 для здоровья в соответствии с NFPA 704, что указывает на то, что воздействие должно вызывать только незначительные остаточные повреждения.
Основной опасностью для здоровья при использовании диэтиленгликоля является риск отравления. Химические свойства соединения позволяют выдавать его за поддельный глицерин, универсальное нетоксичное соединение, используемое в качестве подсластителя в пищевых продуктах и противовирусного средства в медицинской промышленности. Многие смертельные случаи произошли из-за того, что продукты, произведенные с использованием глицерина, были загрязнены диэтиленгликолем.
При проглатывании соединения следует немедленно ввести фомепизол или этанол для предотвращения метаболизма. Хотя фомепизол имеет минимальные побочные эффекты, это очень дорогой вариант лечения. Позже, в фазах отравления, когда метаболизируется ДЭГ, диализ может быть единственным оставшимся вариантом для человека.
Для чего используется диэтиленгликоль?
Диэтиленгликоль имеет множество применений в промышленности. Табачная промышленность использует его гигроскопические свойства, используя его в качестве увлажнителя в табачных изделиях для контроля влажности табачного наполнителя. Это же свойство также делает его полезным при обработке бумаги, пробки, клея и целлофана, и он используется в качестве осушителя в газовой промышленности, где он удаляет воду из газопроводов.
Соединение также используется в качестве промежуточного химического вещества при производстве ненасыщенных полиэфирных смол, пластификаторов, акрилатных и метакрилатных смол и уретанов. В США и Западной Европе таким образом потребляется 51% ДЭГ.
Однако в Японии он в основном используется в качестве добавки для измельчения цемента. Его также можно использовать при экстракции нефтяным растворителем, а также в печатных красках и шовных смесях для гипсокартона.
В настоящее время диэтиленгликоль вытесняется триэтиленгликолем в некоторых областях его применения, поскольку более низкая токсичность триэтиленгликоля делает его более привлекательным для производителей.
 2
2
