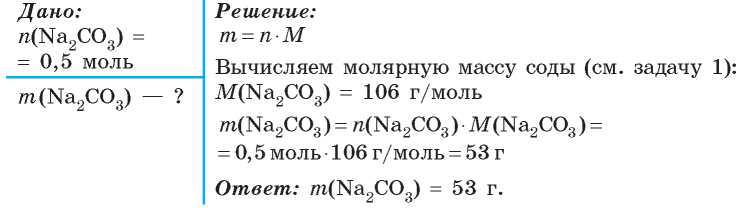Содержание
Цены и новости на рынке химии
Новости и события
На заводе «Димитровградхиммаш» изготовили уникальную колонну разделения изомеров весом 94 тонны
Губернатор Алексей Русских показал в соцсетях уникальное оборудование, изготовленное на заводе «Димитровградхиммаш». Колонна разделения изомеров была выполнена для отечественного заказчика из отр…
«КомиПак» наладила производство белой упаковочной основы
Вести бизнес максимально независимо от внешних рынков уже научились в большинстве российских регионов. Так, в Сыктывкаре наладили производство картона для пищевой упаковки. Выпускают его под марк…
Ильясов: В Туркменистане сконцентрированы большие запасы брома
Возрастающие с каждым днём потребности народного хозяйства Туркменистана в различных видах химической продукции определяют практическую необходимость планомерного и всестороннего и…
PRefChem планирует перезапустить свой завод по производству бутадиена
Нефтеперерабатывающий и нефтехимический комплекс мощностью 300 тыс. барр./сутки в Малайзии, управляемый как совместное предприятие Petronas и Saudi Aramco, возобновил работу после более чем 2-лет…
барр./сутки в Малайзии, управляемый как совместное предприятие Petronas и Saudi Aramco, возобновил работу после более чем 2-лет…
Отечественные производители средств защиты растений получили возможность снизить издержки
До конца 2023 года производители пестицидов Евразийского экономического союза (ЕАЭС) получили возможность снизить до 0% ставку ввозной таможенной пошлины на ряд необходимых в производстве активны…
Экспорт удобрений в 2021 г.
Экспорт
удобрений занимает ведущие позиции в экспортном секторе
химической отрасли страны. По итогам 2021 г. стоимость
экспорта удобрений занимает долю 33% в валютной выручке от
…
Информация
Этиленгликоль купить в челябинске
На заводе «Димитровградхиммаш» изготовили уникальную колонну разделения изомеров весом 94 тонны
«КомиПак» наладила производство белой упаковочной основы
Ильясов: В Туркменистане сконцентрированы большие запасы брома
Этиловый эфир этиленгликоля
На заводе «Димитровградхиммаш» изготовили уникальную колонну разделения изомеров весом 94 тонны
«КомиПак» наладила производство белой упаковочной основы
Ильясов: В Туркменистане сконцентрированы большие запасы брома
Каталог организаций и предприятий
Масса-К
. ..
..
ПКФ ХимАвангард
поставки химической продукции технического назначения и продукции собственного производства-растворы на основе пропиленгликоля/ этиленгликоля марок РВП/ВГР различной концентрации и ТЕНСО-40, ТЕНСО-65 .
Булат
1. Масса корундовая СКНГ-94 ТУ 1523-009-00188162-97;
2. Масса корундовая МКН-94
ТУ 14-194-206-94;
3. Масса корундовая СКБТ
ТУ 14-8-381-89;
4. Смесь муллитокорундовая СМКБ ТУ 1523-022-00190495-2002;
5.
ЭНЕРГОПРОМ — НЭЗ
Выпускаемая продукция: графитированные электроды; графит измельченный; аноды графитированные; блоки графитированные; блоки анодные обожженные; блоки подовые; масса анодная углеродная; масса электродна…
ЭПМ-НовЭз
ОАО «Новосибирский
электродный завод»
Основная продукция:
Графитированные,
угопьные эпектроды, эпектродная масса,
катодные блоки…
ПКФ РУНО
Продам из наличия титан слитки следующих марок: ВТ1-0, 5В, 7М, ВТ22, ВТ23, ВТ5-1, ОТ4, ОТ4-0, Спл37. На остатках сумарная масса 729, 10 кг. (ожидаем пополнение склада). Так же алюминий в чушках АВ 87-20…
(ожидаем пополнение склада). Так же алюминий в чушках АВ 87-20…
Предложения на покупку и продажу продукции
Моноэтиленгликоль
Прозрачная маслянистая жидкость без запаха и цвета.
Моноэтиленгликоль сильно понижает температуру замерзания воды, поэтому его используют для приготовления охлаждающих жидкостей.
Моноэтиленгликоль (МЭ…
оборудование рециклинга, регенерации, восстановление жидких химических отходов.
Устанавливаем оборудование рециклинга, ( восстановление ), жидких химических отходов и неликвидов с хранения в их первоначальное состояние.
Подбор оборудования, монтаж аппаратов, технология процесса, …
услуги регенерации, рециклинга, отработанной промышленной химии неликвидов с хранения, брак.
Наша компания имеет универсальное оборудование по рециклингу отработанной жидкой органической химии, неликвидов с хранения, последствия не правильной транспортировки, брак, отработанные растворы.
Оказ…
Какую массу этиленгликоля получим.
 задача 3 параграф 22 химия 10 класс Рудзиис – Рамблер/класс
задача 3 параграф 22 химия 10 класс Рудзиис – Рамблер/класс
Какую массу этиленгликоля получим. задача 3 параграф 22 химия 10 класс Рудзиис – Рамблер/класс
Интересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
Всем привет! Подскажите решение) От меня огромное спасибо) Какую массу (в кг) этиленгликоля можно получить из 108 м1 2 3 этилена (н. у.), если известно, что массовая доля выхода продукта реакции составляет 0,78 от теоретического?
у.), если известно, что массовая доля выхода продукта реакции составляет 0,78 от теоретического?
ответы
привет! ну вот смотри:
Уравнение реакции:

Вычислим количество вещества этилена:

По уравнению реакция из 1 моль этилена образуется 1 моль этиленгли-коля, значит из 4821 моль этилена при теоретическом 100% выходе образовалось бы 4821 моль этиленгликоля. Поскольку практический выход составляет 78%, или 0,78, образуется 0,78 • 4821 моль ≈ 3760 моль.
Молекулярная формула этиленгликоля С2Н6О2, вычислим молярную массу этиленгликоля:

Вычислим массу этиленгликоля:

Ответ: можно получить 233 кг этиленгликоля.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
Экскурсии
Мякишев Г.Я.
Досуг
Химия
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
Когда в 2018 году намечено проведение основного периода ЕГЭ?
На какие даты намечено проведение основного периода ЕГЭ? Расскажите, пожалуйста, известно ли уже? (Подробнее…)
ШколаЕГЭВыпускнойЭкзаменыНовости
Это правда, что будут сокращать иностранные языки в школах?
Хочется узнать, когда собираются сократить иностранные языки в школе? Какой в итоге оставят? (Подробнее…)
ШколаНовостиИностранные языки
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)…
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
(Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
2.7: Концепция крота и константа Авогадро
-
- Последнее обновление
- Сохранить как PDF
-
- Идентификатор страницы
- 24179
- Определите число атомов каждого элемента в эмпирической формуле.
- Найдите атомную массу каждого элемента из таблицы Менделеева и умножьте атомную массу каждого элемента на количество атомов этого элемента.
- Сложите массы, чтобы получить формулу массы.
- 2 моля H 2
- 1 моль О 2 и
- 2 моля H 2 O
- молей.

- молекулы.
- Используйте молекулярную формулу соединения для расчета его молекулярной массы в граммах на моль.
- Преобразуйте массу в моли, разделив полученную массу на молярную массу соединения.
- Преобразуйте моли в молекулы, умножив число молей на число Авогадро.
- Si 3 N 4 (нитрид кремния), используемые в качестве подшипников и роликов
- (CH 3 ) 3 N (триметиламин), ингибитор коррозии
- 1,71 г
- 0,721 г
- 2 моля H 2
- 1 моль О 2 и
- 2 моля H 2 O
- Для анализа химических превращений необходимо использовать стандартизированную единицу измерения, называемую моль.
- Наверх
-
- Была ли эта статья полезной?
-
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
-
- Теги
-
- Этиленгликоль представляет собой бесцветную, слегка сладковатую жидкость без запаха.
- Используется в антифризах и при производстве полиэфирных волокон.

- Этиленгликоль представляет собой полярную молекулу и растворим в воде.
- Хороший растворитель для многих веществ.
\[ 2 \times \text { атомная масса углерода} = 2 \, атомы \слева ( {12,011 \, а.е.м. \над атомами } \справа ) = 24,022 \,а.е.м. \]
\[ 6 \times \text { атомная масса водорода} = 2 \, атомы \слева ( {1,0079 \, а.е.м. \над атомами } \справа ) = 6,0474 \,а.е.м. \]
\[ 1 \times \text { атомная масса кислорода} = 1 \, атомы \слева ( {15,9994 \, а.е.м. \ над атомами } \справа ) = 15,994 \,а.е.м. \]
C Сложение масс дает молекулярную массу:
\[ 24,022 \,а. е.м. + 6,0474 \,а.е.м. + 15,9994 \,а.е.м. = 46,069 \,а.е.м.\]
е.м. + 6,0474 \,а.е.м. + 15,9994 \,а.е.м. = 46,069 \,а.е.м.\]
В качестве альтернативы мы могли бы использовать преобразование единиц измерения, чтобы получить результат за один шаг:
\[ \left [ 2 \, атомы C \left ( {12,011 \, а.е.м. \над 1 \, атом C} \right ) \right ] + \left [ 6 \, атомы H \left ( {1,0079 \, а.е.м. \ над 1 \, атом H} \ справа ) \ справа ] + \ слева [ 1 \, атомы C \ слева ( {15,9994 \, а.е.м. \ над 1 \, атом 0} \ справа ) \ справа ] = 46,069 \, а.е.м. \]
Тот же расчет можно выполнить в табличном формате, что особенно полезно для более сложных молекул:
\[ 2 C \, \, \, (2\, атомы) (12,011 \, а.е.м./атом) = 24,022 \, а.е.м. \]
\[ 6 H \, \, \, (6\, атомов) (1,0079 \, а.е.м./атом) = 6,0474 \, а.е.м. \]
\[ + 1O \, \, \, (1\, атомы) (15,9994 \, а.е.м./атом ) = 15,9994 \, а.е.м. \]
\[ C_2H_6O \, \, \, \, \, \text {молекулярная масса этанола} = 46,069 \, а.е.м. \]
Упражнение \(\PageIndex{1}\): Молекулярная масса фреона
Рассчитайте молекулярную массу трихлорфторметана, также известного как фреон-11, сокращенная структурная формула которого \(CCl_3F\).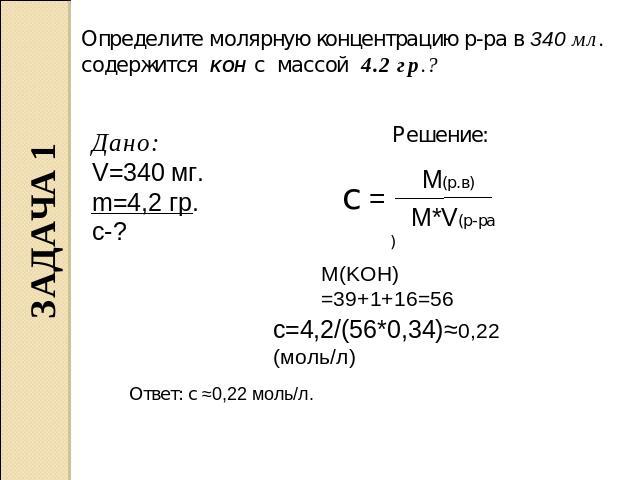 До недавнего времени он использовался в качестве хладагента. Структура молекулы фреона-11 следующая:
До недавнего времени он использовался в качестве хладагента. Структура молекулы фреона-11 следующая:
Ответ : 137.368 \,а.е.м.
В отличие от молекул, образующих ковалентные связи, ионные соединения не имеют легко идентифицируемой молекулярной единицы. Поэтому для ионных соединений вместо молекулярной массы используется формула массы (также называемая массой эмпирической формулы) соединения. Масса формулы представляет собой сумму атомных масс всех элементов в эмпирической формуле, каждый из которых умножается на его нижний индекс (записанный или подразумеваемый). Это прямой аналог молекулярной массы ковалентного соединения. Единицами являются атомные единицы массы.
Примечание
Атомная масса, молекулярная масса и формула массы имеют одни и те же единицы измерения: атомные единицы массы.
Определение молярной массы молекулы: https://youtu. be/wOjQjZqX7l8
be/wOjQjZqX7l8
Пример \(\PageIndex{2}\): Масса формулы фосфата кальция
Вычислите массу формулы Ca 3 (PO 4 ) 2 , обычно называемого фосфатом кальция. Это соединение является основным источником кальция, содержащегося в коровьем молоке.
Дано : ионное соединение
Запрошено : формула массы
Стратегия :
Решение :
A Эмпирическая формула — Ca 3 (PO 4 ) 2 — показывает, что простейшая электрически нейтральная единица фосфата кальция содержит три иона Ca 2 90 4 4 + 9011 PO1 + 9011 3 − ионы. Масса формулы этой молекулярной единицы рассчитывается путем сложения атомных масс трех атомов кальция, двух атомов фосфора и восьми атомов кислорода.
Масса формулы этой молекулярной единицы рассчитывается путем сложения атомных масс трех атомов кальция, двух атомов фосфора и восьми атомов кислорода.
B Беря атомные массы из таблицы Менделеева, получаем
\[ 3 \times \text {атомная масса кальция} = 3 \, атомы \left ( {40,078 \, а.е.м. \ над атомом } \right ) = 120,234 \, а.е.м. \]
\[ 2 \times \ text {атомная масса фосфора} = 2 \, атомы \left ( {30,973761 \, а.е.м. \над атомом } \right ) = 61,947522 \, а.е.м. \]
\[ 8 \times \text {атомная масса кислорода} = 8 \, атомы \left ( {15,9994 \, а.е.м. \над атомом } \right ) = 127,9952 \, а.е.м. \]
C Сложение масс дает формулу массы Ca 3 (PO 4 ) 2 :
\[120,234 \,а.е.м. + 61,947522 \, а.е.м. + 127,9952 \, а.е.м. = 310,177 \, а.е.м. \]
2 за один шаг с использованием преобразования единиц измерения или табличного формата:
\[ \left [ 3 \, атомы Ca \left ({40,078 \, amu \over 1 \, атом Ca } \right ) \right ] + \left [ 2 \, атомы P \left ({30,973761 \, а. е.м. \более 1 \, атом P } \right ) \right ] + \left [ 8 \, атомы O \left ({15,9994 \, а.е.м. \более 1 \, атом O } \right ) \right ] \]
е.м. \более 1 \, атом P } \right ) \right ] + \left [ 8 \, атомы O \left ({15,9994 \, а.е.м. \более 1 \, атом O } \right ) \right ] \]
\[= 310,177 \, а.е.м. \]
\[ 3Ca \, \, \, \, (3\, атомы)(40,078 \, а.е.м./атом) = 120,234 \, а.е.м. \]
\[ 2P \, \, \, \, (2\, атомы)(30,973761 \, а.е.м./атом) = 61,947522 \, а.е.м. \]
\[ + 😯 \, \, \, \, (8 \, атомы)(15,9994 \, а.е.м./атом) = 127,9952 \, а.е.м. \]
\[ Ca_3P_2O_8 \, \, \, \, \text {формульная масса Ca}_3(PO_4)_2 = 310,177 \, а.е.м. \]
\[(моль)(молярная масса) \rightarrow масса \label{2.7.1}\]
или, точнее,
\[ моль \влево ( {граммы \над молем } \вправо ) = граммы \]
И наоборот, чтобы перевести массу вещества в моли:
\[ \left ( {граммы \по молярной массе } \right ) \rightarrow моли \label{2.7.2A}\]
\[ \left ({ граммы \над граммами/моль} \right ) = граммы \left ( {моль \ над граммами } \right ) = моли \label{2. 7.2B}\]
7.2B}\]
\[2H_{2 (g)} + O_{2(g)} \rightarrow 2H_2O_{(l)}\]
для производства двух молей воды потребуется потребление 2 молей \(H_2\) и одного моля \( О_2\). Поэтому при рассмотрении эта конкретная реакция
будет считаться стехиометрически эквивалентными количествами .
Эти стехиометрические соотношения, полученные из сбалансированных уравнений, могут использоваться для определения ожидаемых количеств продуктов при данных количествах реагентов. Например, сколько молей \(H_2O\) получится из 1,57 моль \(O_2\)?
\[ (1,57\; моль\; O_2) \left( \dfrac{2\; моль H_2O}{1\;моль\;O_2} \right) = 3,14\; моль\; H_2O\]
Отношение \( \left( \dfrac{2\; моль\; H_2O}{1\;моль\;O_2} \right)\) представляет собой стехиометрическое соотношение между \(H_2O\) и \( O_2\) из сбалансированного уравнения этой реакции.
Пример \(\PageIndex{3}\)
Для сжигания бутана (\(C_4H_{10}\)) сбалансированное уравнение:
\[2C_4H_{10(l)} + 13O_{2( г)} \rightarrow 8CO_{2(г)} + 10H_2O_{(л)}\]
9{-2} \; моль\; CO_2 \left( \dfrac{44,0\; г\; CO_2}{1\; моль\; CO_2} \right) = 3,03\;г \; СО_2\]
Обязательно обращайте внимание на единицы измерения при переводе массы в моли. Рисунок \(\PageIndex{1}\) представляет собой блок-схему преобразования между массой; количество родинок; и количество атомов, молекул или формульных единиц. Использование этих преобразований показано в примере \(\PageIndex{3}\) и примере \(\PageIndex{4}\).
Рисунок \(\PageIndex{1}\): блок-схема преобразования массы; Количество родинок; и количество атомов, молекул или формульных единиц
Преобразование граммов, молей и атомов: https://youtu.be/rOvErpAnoCg
Пример \(\PageIndex{4}\)
Для 35,00 г этиленгликоля (HOCH 2 CH 2 OH), который используется в чернилах для шариковых ручек, рассчитайте количество
Дано : масса и молекулярная формула
Запрошено : количество молей и количество молекул
Strategy :
Раствор :
а. A Молекулярную массу этиленгликоля можно рассчитать по его молекулярной формуле с помощью метода, показанного в примере \(\PageIndex{2}\).7.1:
\[ 2C (2 \,атомов)(12,011 \, а.е.м./атом) = 24,022 \, а.е.м. \]
\[ 6H (6 \,атомов)(1,0079 \, а.е.м./атом) = 6,0474 \, а.е.м. \]
\[ 2O (2 \,атомов )(15,9994 \, а.е.м./атом) = 31,9988 \, а.е.м. \]
\[ C_2H_6O_2 \text {молекулярная масса этиленгликоля} = 62,068 \, а. е.м. \]
е.м. \]
Молярная масса этиленгликоля 62,068 г/моль.
B Количество молей этиленгликоля в 35,00 г можно рассчитать путем деления массы (в граммах) на молярную массу (в граммах на моль):
\[ { \text {масса этиленгликоля (г)} \over \text {молярная масса (г/моль)} } = \text {молей этиленгликоля (моль)}\]
So
\[ 35,00 \, г \text {этиленгликоль} \left ( {1 \, моль \text {этиленгликоль} \более 62,068 \, г \text {этиленгликоль} } \right ) = 0,5639 \,моль \text {этиленгликоль } \]
Всегда полезно оценить ответ, прежде чем приступать к фактическим вычислениям. В этом случае указанная масса (35,00 г) меньше молярной массы, поэтому ответ должен быть меньше 1 моль. Расчетный ответ (0,5639{23} \, молекулы \]
Поскольку мы имеем дело с немногим более 0,5 моль этиленгликоля, мы ожидаем, что количество присутствующих молекул будет немного больше половины числа Авогадро, или чуть больше 3 × 10 23 молекул, что действительно так.
\[ 2S (2 \, атомы)(32,065 \, а.е.м./атом) = 64,130 \, а.е.м. \]
\[+ 2Cl (2 \, атомов) (35,453 \, а.е.м./атом) = 70,906 \, а.е.м. \]
\[ S_2Cl_2 \text {молекулярная масса } S_2Cl_2 = 135,036 \, а.е.м. \]
Молярная масса S 2 Cl 2 составляет 135,036 г/моль.
B Масса 1,75 моль S 2 Cl 2 рассчитывается следующим образом:
\[моль S_2Cl_2 \left [\text {молярная масса}\left ({ г \над моль} \right )\right ] \rightarrow масса S_2Cl_2 \, (г) \]
\[1,75\,моль S_2Cl_2\слева ({135,036\,г S_2Cl_2\над 1\,моль S_2Cl_2}\справа ) = 236\,г S_2Cl_2\]
б.
A Массовая формула Ca(ClO) 2 получается следующим образом:
\[1Ca (1 \, атом)(40,078 \, а.е.м./атом) = 40,078 \, а.е.м. \]
\[2Cl (2 \, атомы)(35,453 \, а.е.м./атом) = 70,906 \, а.е.м. \]
\[+ 2O (2 \, атомы)(15,9994 \, а.е.м./атом) = 31,9988 \, а. е.м. \]
е.м. \]
\[ Ca (ClO)_2 \text { формула массы } Ca (ClO)_2 = 142,983 \, а.е.м.\]
Молярная масса Ca(ClO) 2 142,983 г/моль.
B Масса 1,75 моль Ca(ClO) 2 рассчитывается следующим образом:
\[ моль Ca(ClO)_2 \left [{\text {молярная масса} Ca(ClO)_2 \более 1 \, моль Ca(ClO)_2} \right ]=масса Ca(ClO)_2\]
\[ 1,75 \, моль Ca(ClO)_2 \left [ {142,983 \, г Ca(ClO)_2 \над 1 \, моль Ca(ClO)_2 } \right ] = 250 \, г Ca(ClO) _2 \]
Поскольку 1,75 моль меньше 2 моль, конечное количество в граммах в обоих случаях должно быть меньше, чем удвоенная молярная масса, что и есть.
Упражнение \(\PageIndex{5}\)
Рассчитайте массу 0,0122 моль каждого соединения.
Ответ :
Коэффициенты в сбалансированном химическом уравнении можно интерпретировать как относительное количество молекул, участвующих в реакции, так и как относительное количество молей. Например, в сбалансированный уравнение:
Например, в сбалансированный уравнение:
\[2H_{2(г)} + O_{2(г)} \rightarrow 2H_2O_{(л)}\]
для производства двух молей воды потребовалось бы потребление 2 молей \(H_2\) и одного моля \(O_2\). Следовательно, при рассмотрении этой конкретной реакции
будет считаться стехиометрически эквивалентными количествами .
Эти стехиометрические соотношения, полученные из сбалансированных уравнений, могут быть использованы для определения ожидаемых количеств продуктов при данных количествах реагентов. Например, сколько молей \(H_2O\) получится из 1,57 моль \(O_2\)?
\[ (1,57\; моль\; O_2) \left( \dfrac{2\; моль H_2O}{1\;моль\;O_2} \right) = 3,14\; моль\; H_2O\]
Отношение \( \left( \dfrac{2\; моль\л H_2O}{1\;моль\;O_2} \right)\) представляет собой стехиометрическое соотношение между \(H_2O\) и \(O_2\) из сбалансированное уравнение этой реакции. {-2} \; моль\; C_4H_{10}\] 9{-2} \; моль\; CO_2 \left( \dfrac{44,0\; г\; CO_2}{1\; моль\; CO_2} \right) = 3,03\;г \; CO_2\]
{-2} \; моль\; C_4H_{10}\] 9{-2} \; моль\; CO_2 \left( \dfrac{44,0\; г\; CO_2}{1\; моль\; CO_2} \right) = 3,03\;г \; CO_2\]
Таким образом, общая последовательность шагов для решения этой задачи была следующей:
Аналогичным образом мы могли определить массу произведенной воды или потребленного кислорода и т. д.
Молекулярная масса и формульная масса соединения получаются путем сложения атомных масс атомов, присутствующих в молекулярной формуле или эмпирической формуле, соответственно; единицами измерения обоих являются атомные единицы массы (а.е.м.). Моль — это единица, используемая для измерения числа атомов, молекул или (в случае ионных соединений) формульных единиц в данной массе вещества. Моль определяется как количество вещества, которое содержит количество атомов углерода ровно в 12 г углерода-12, число Авогадро (6,022 × 10 23 ) атомов углерода-12. Молярная масса вещества определяется как масса 1 моля этого вещества, выраженная в граммах на моль, и равна массе 6,022 × 10 23 атомов, молекул или формульных единиц этого вещества.
Молярная масса вещества определяется как масса 1 моля этого вещества, выраженная в граммах на моль, и равна массе 6,022 × 10 23 атомов, молекул или формульных единиц этого вещества.
Этиленгликоль – применение, молярная масса, свойства и часто задаваемые вопросы
Давайте поближе познакомимся с этиленгликолем?
Этиленгликоль – Молярная масса: Этиленгликоль представляет собой бесцветную жидкость без запаха и слегка сладковатого вкуса, которая используется в основном в качестве охлаждающей жидкости в транспортных средствах, а также в другом оборудовании. Он также используется в качестве растворителя в некоторых красках и чернилах.
Он также используется в качестве растворителя в некоторых красках и чернилах.
Зарегистрируйтесь и получите бесплатные пробные тесты и учебные материалы
Класс
—Класс 6Класс 7Класс 8Класс 9Класс 10Класс 11Класс 12
Вы ученик Шри Чайтаньи?
НетДа
+91
Подтвердить OTP-код (обязательно)
Я согласен с условиями и политикой конфиденциальности.
Характеристики этиленгликоля
Этиленгликоль представляет собой бесцветную, слегка вязкую жидкость без запаха и сладкого вкуса. Это полярная молекула, растворимая в воде. Этиленгликоль является хорошим растворителем как для полярных, так и для неполярных молекул. Он используется в качестве охлаждающей жидкости в автомобилях и других двигателях, а также входит в состав антифриза.
Свойства
Способы распространения:
Вирус может распространяться разными способами. Он может распространяться по воздуху, при контакте с инфицированным человеком или при контакте с инфицированным животным.
Пути воздействия
Пути воздействия вещества могут различаться в зависимости от химического вещества. Вдыхание, проглатывание и абсорбция являются наиболее распространенными путями воздействия. Вдыхание происходит при вдыхании вещества. Проглатывание происходит при проглатывании вещества. Всасывание происходит, когда вещество всасывается через кожу или слизистые оболочки.
Структура этиленгликоля
Молекулярная структура этиленгликоля показана на изображении ниже.
Этиленгликоль представляет собой органическое соединение, состоящее из основной углеродной цепи с двумя связанными с ней атомами кислорода.
Каково применение этиленгликоля?
Некоторые виды использования этиленгликоля включают:
— В качестве растворителя во многих продуктах, включая антифриз, тормозную жидкость и краску
— В производстве полиэфирных волокон и смол
– При производстве полиэтилентерефталата, синтетического волокна, используемого в одежде и других изделиях
– В качестве хладагента в автомобильных радиаторах и кондиционерах
Воздействие эфиров гликоля на водные организмы
Токсичность эфиров гликоля для водных организмов варьируется в зависимости от на конкретном эфире гликоля. Некоторые эфиры гликоля, такие как этиленгликоль и пропиленгликоль, высокотоксичны для водных организмов, в то время как другие, такие как метилгликоль, относительно нетоксичны.
Какова молярная масса этиленгликоля?
Молярная масса этиленгликоля 62,06 г/моль.
Как производить этиленгликоль?
Наиболее распространенным способом производства этиленгликоля является гидратация окиси этилена.