Содержание
Формула этиленгликоля: как это вещество изменило нашу жизнь | Блог
Утро многих людей начинается похоже: выпиваем бутылку воды, заводим машину, чтобы поехать на работу, сидим в офисе, задумчиво глядя на стену с календарем, где уже отмечены даты отпуска. Но мало кто знает, что ничего этого бы не было, если бы не этиленгликоль (моноэтиленгликоль, или МЭГ), благодаря которому появилась пластиковая тара, антифриз и даже краска для стены. Рассказываем о незаменимых свойствах этиленгликоля и сферах его применения.
Рассказываем, что такое этиленгликоль
Многопрофильное вещество
Этиленгликоль – один из наиболее популярных видов нефтехимического сырья и компонент для многих промышленных продуктов. Это двухатомный спирт, который в очищенном виде выглядит, как бесцветная жидкость без запаха. Вещество достаточно токсично и отнесено к третьему классу опасности по международной классификации.
Формула этиленгликоля
- в высокой концентрации он переносит нагрев почти до 200 градусов, что позволяет использовать их в теплоносителях;
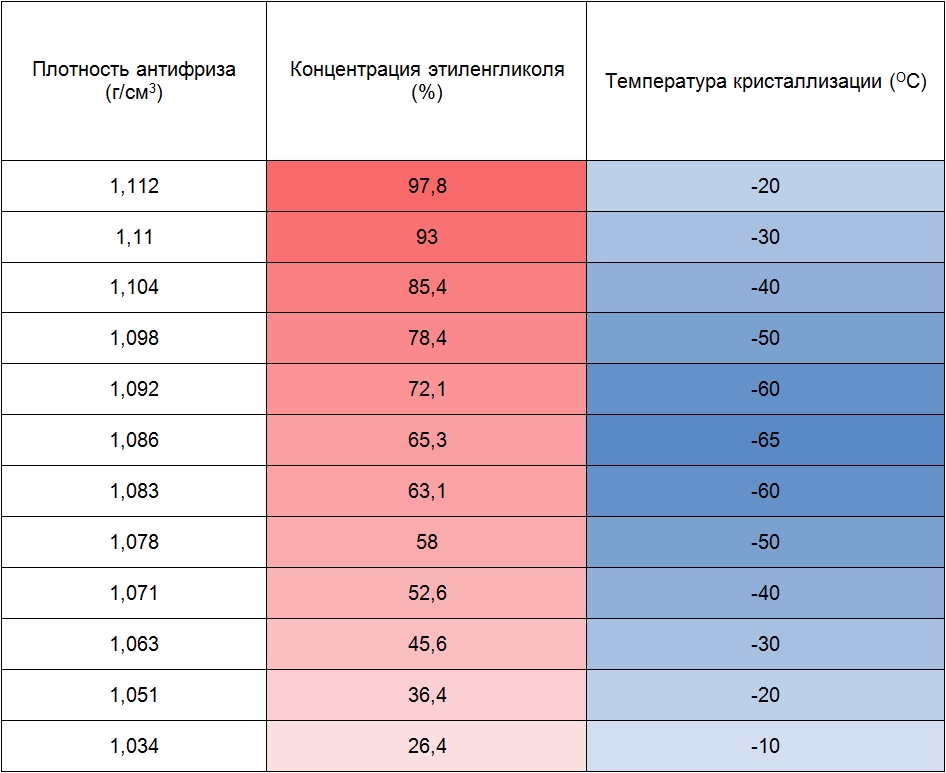
- температура их кристаллизации в смеси с водой может опускаться вплоть до 75 градусов ниже нуля.
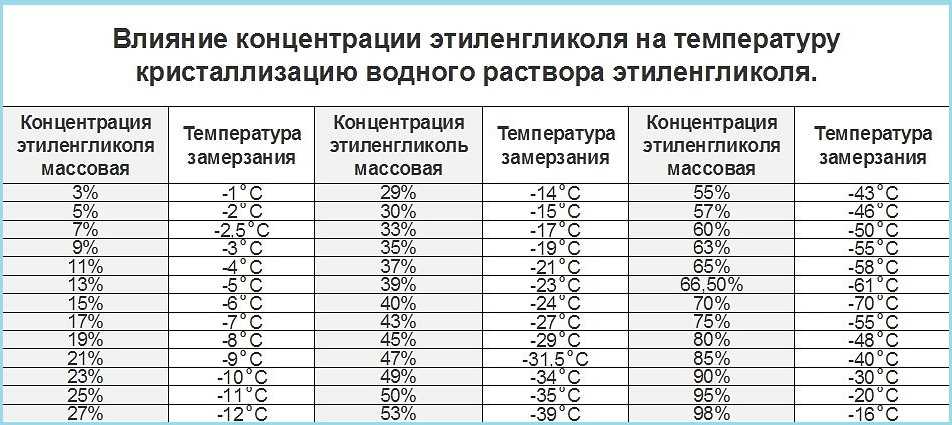
 Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
Основные характеристики этиленгликоля
Но полвека с момента его открытия этиленгликоль фактически «пролежал на полке».
От нефти к «зеленым» технологиям. История создания этиленгликоля
История производства этиленгликоля началась в середине 19 века. Впервые это вещество в 1859 году синтезировал французский химик Шарль Адольф Вюрц. Вначале — из диацетата этиленгликоля, а в год спустя – гидратацией этиленоксида. Но потом еще полвека этиленгликоль не получал широкого распространения.
Его свойства оценили только в ходе Первой мировой войны. Германия начала применять этиленгликоль при производстве взрывчатки, используя в качестве сырья дихлорэтан. Следом были запущены мощности по его выпуску в США на базе этиленхлоргидрина.
Наиболее масштабное производство этиленгликоля начала компания Carbide в 1937 году, используя технологию газофазного окисления этилена и этиленоксида.
Монополия на такой способ производства сохранялась до 1953 года.
За счет низкой себестоимости и более конкурентного набора свойств к середине 20 века этиленгликоль полностью вытеснил глицерин из промышленного производства динамита, а также из состава охлаждающей жидкости, спрос на которую стремительно рос с развитием машиностроения.
Сейчас этиленгликоль производится в основном путем гидратации (присоединение молекул воды) оксида этилена. В одном из вариантов это происходит при давлении в 10 атмосфер и температуре около 180 градусов в присутствии кислотного катализатора. На выходе получается жидкость, содержащая до 90% чистого этиленгликоля.
Побочные продукты – диэтиленгликоль и триэтиленгликоль – также используются в промышленности, например, в дезинфекторах, системах охлаждения воздуха и при производстве пластификаторов.
Другой вариант синтеза МЭГ – гидратация этилена с участием серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов.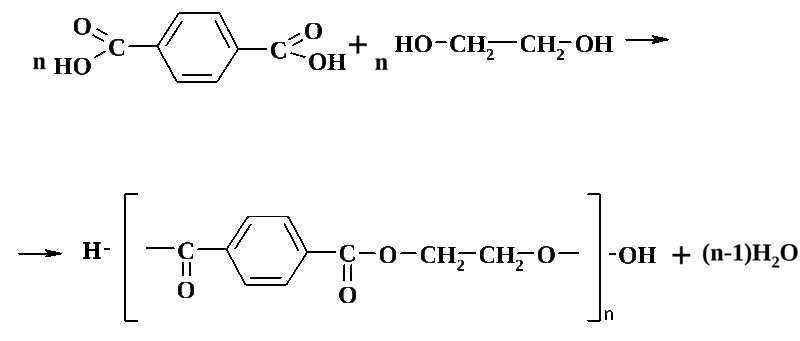
На фоне прогнозируемого сокращения добычи углеводородов повышается интерес к экологичным методам выпуска этиленгликоля. Американская компания IPCI нашла новый способ производства многоатомных спиртов из сахаров любого происхождения и уже запустила по этой технологии завод на 10 тыс. тонн продукции в год в Китае.
Запустить заводы по производству этиленгликоля из растительного сырья в середине 2020-ых годов планируется и в Европе.
После отвязки цены на МЭГ от нефтяных котировок, рынок станет прозрачнее, а сферы применения этиленгликоля могут расшириться за счет разработки новых продуктов.
Пластик, антифриз и краски. Где используется этиленгликоль?
Основная часть МЭГ идет на производство полиэтилентерефталата (ПЭТ). Это одна из разновидностей полимеров, продукт поликонденсации этиленгликоля с терефталевой кислотой. ПЭТ применяется для получения синтетических волокон, пленок и пластиковых бутылок.
Именно со сферой ПЭТ связаны позитивные перспективы роста объемов потребления этиленгликоля. Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Эксперты уверены, что потребление ПЭТ, а, следовательно, и этиленгликоля будет расти в ближайшие годы, несмотря на запланированное ужесточение в ЕС и некоторых других странах норм использования продукции из полиэтилентерефталата. Тем более что сроки внедрения новых требований существенно сдвинулись вправо из-за ситуации с коронавирусом, которая повысила спрос на одноразовую пластиковую посуду и тару.
Алексей Костин, генеральный директор Центра отраслевых исследований
Хотя ПЭТ незаменим во многих областях, этот продукт из первичного сырья будет замещать его рециркулированная версия из вторсырья. Степень влияния будет зависеть от регулирования в странах потребления ПЭТ, которые могут ввести обязательный норматив на r-PET в волокне или взять на себя какие-либо обязательства в области текстильного бизнеса.
Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.
Еще один крупный сектор применения этиленгликоля в качестве сырья – изготовление охлаждающих жидкостей. Добавленный в воду МЭГ мешает ей замерзнуть в ледяной монолит, что является угрозой для двигателя, и помогает сформировать отдельные ледяные кристаллы, которые не препятствуют запуску мотора.
Благодаря низкой температуре замерзания в смеси с водой, этиленгликоль используются в противообледенительных жидкостях для авиации, которыми самолеты покрывают перед взлетом.
В качестве компонента антифриза МЭГ впервые стали использоваться еще в 1926 году, а более масштабное применение началось незадолго до Второй мировой войны в основном в военной технике.
На тот момент мало кто обращал внимание на главную проблему охлаждающих жидкостей с использованием этиленгликолей – коррозию металла двигателя от соприкосновения с ним.
Во многом это объяснялось тем, что детали были чугунные, а радиаторы – латунные. Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Этиленгликоль широко используется при производстве красок как растворитель. В текстильном секторе он применяется для формирования тканей и скручивания нитей, а также как один из главных составляющих красителей для кожи.
Многообещающая динамика
Объемы производства этиленгликоля, которые уже сейчас в мире приближаются к 30 млн. тонн, постоянно увеличиваются.
В Китае к 2020 году их выпуск за последние пять лет вырос на треть, превысив 10 млн. тонн. Еще около 6 млн. тонн производит второй по величине экспортер – Саудовская Аравия.
По прогнозам экспертов, как минимум до 2025 года динамика роста спроса на МЭГ составит 5-6% в год. Россия пока не занимает существенной доли в мировом производстве. В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
Подробнее о том, как будет развиваться рынок этиленгликоля, читайте в статье «5 лет спрос будет расти, но потом все изменится. Что ждет рынок этиленгликоля в ближайшие 10 лет?»
Благодаря возможности разностороннего применения, этиленгликоль стал незаменимым компонентом для многих промышленных отраслей. При этом экономическая эффективность его применения и перспективы дальнейшего развития в качестве экологичного сырья гарантируют МЭГ стабильный спрос еще долгие годы.
Этиленгликоль
Оптовые поставки по России и странам СНГ
Узнать стоимость
Синонимы: Моноэтиленгликоль, МЭГ, 1,2-этандиол, 1,2-диоксиэтан, Ethylene glycol
Формула: HOCh3Ch3OH
CAS: 107-21-1
Код ТН ВЭД: 2905310000
Стандарт:
ГОСТ 19710-83
Описание:
Этиленгликоль — горючая жидкость.
Применение:
Этиленгликоль является продуктом гидратации окиси этилена. Предназначен для использования в производствах синтетических волокон, растворителей, низкозамерзающих и гидравлических жидкостей.
ГОСТ 19710-83
Оставить заявку
| Технические характеристики | Норма | |
|---|---|---|
| Высший сорт | Первый сорт | |
| Массовая доля этиленгликоля, %, не менее | 99,8 | 98,5 |
| Массовая доля диэтиленгликоля, %, не не более | 0,05 | 1,0 |
| Цвет в единицах Хазена, не более: | ||
| в обычном состоянии | 5 | 20 |
| после кипячения с соляной кислотой | 20 | не нормируется |
| Массовая доля остатка после прокаливания, %, не более | 0,001 | 0,002 |
| Массовая доля железа, %, не более | 0,00001 | 0,0005 |
| Массовая доля воды, %, не более | 0,1 | 0,5 |
| Массовая доля кислот в пересчете на уксусную, %, не более | 0,0006 | 0,005 |
| Показатель преломления при 20°С | 1,431-1,432 | 1,430-1,432 |
| Пропускание в ультрафиолетовой области спектра, %, не менее, при длинах волн, нм: | ||
| 220 | 75 | не нормируется |
| 275 | 95 | не нормируется |
| 350 | 100 | не нормируется |
Упаковка:
Этиленгликоль заливают в железнодорожные цистерны, а также алюминиевые и стальные неоцинкованные бочки.
Хранение:
Этиленгликоль хранят в герметичных емкостях из алюминия, коррозионностойкой или алюминированной стали. Продукт в бочках хранится в крытых неотапливаемых складских помещениях. Бочки с этиленгликолем должны храниться вертикально. Высота штабеля бочек не должна превышать три яруса. Гарантийный срок хранения этиленгликоля высшего сорта — 1 год, первого сорта — 2 года со дня изготовления.
Транспортировка:
Этиленгликоль в бочках транспортируют в крытых транспортных средствах всеми видами транспорта, а также наливом в железнодорожных цистернах с котлами из алюминия или коррозионностойкой стали.
Техника безопасности:
Ядовитые вещества, нелетучие без дополнительного вида опасности.
Выгодно
Низкие цены за счёт прямых контрактов с производителями
Надёжно
Работаем более 20 лет (с 1997 года) под одним ИНН.
Товар на складе
Более 3 000 тонн продукции в наличии на наших складах
Качество гарантируем
Работаем только с проверенными поставщиками.
Доставим как надо
Контролируем товар на всем пути
Введите ваше имя
Введите ваш телефон
Нажимая кнопку «Получить бесплатную консультацию», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Узнать стоимость», Вы соглашаетесь с условиями Политики конфиденциальности.
Наш специалист свяжется с Вами в ближайшее время.
Заявка направленная после 17:00 (+7 GMT),
обрабатывается на следующий день в рабочее время.
Введите ваше имя
Введите ваш телефон
Укажите ваш регион (город)
Нажимая кнопку «Оставить заявку», Вы соглашаетесь с условиями Политики конфиденциальности.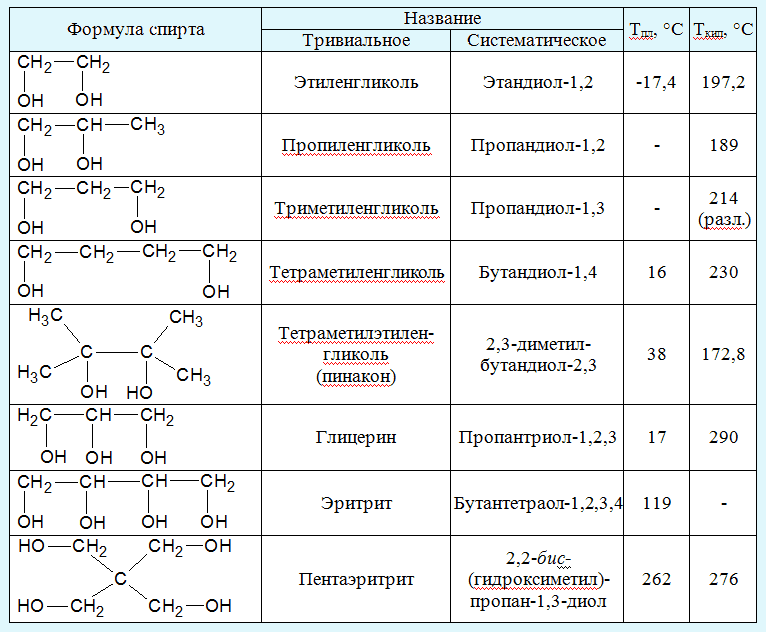
этилен_гликоль
Этиленгликоль ( моноэтиленгликоль ( MEG ), название IUPAC: этан-1,2-диол ) представляет собой спирт с двумя группами -OH (диол), химическое соединение, широко используемое в качестве автомобильного антифриза. Дополнительные рекомендуемые знания
ПроизводствоЭтиленгликоль получают из этилена через промежуточный этиленоксид. Оксид этилена реагирует с водой с образованием этиленгликоля в соответствии с химическим уравнением
Эта реакция может катализироваться кислотами или основаниями или может происходить при нейтральном pH при повышенных температурах. Эта молекула была обнаружена в космосе Hollis, et al. [2] ИспользованиеОхлаждающая жидкостьВ основном этиленгликоль используется в качестве охлаждающей жидкости или антифриза, например, в автомобилях и персональных компьютерах. Из-за низкой температуры замерзания он также используется в качестве жидкости против обледенения для ветровых стекол и самолетов. Этиленгликоль также широко используется в системах кондиционирования воздуха с охлажденной водой, в которых чиллер или воздухообрабатывающие устройства размещаются снаружи, или в системах, которые должны охлаждаться ниже температуры замерзания воды. ПроизводствоЭтиленгликоль приобретает все большее значение в производстве пластмасс для производства полиэфирных волокон и смол, включая полиэтилентерефталат, который используется для изготовления пластиковых бутылок для безалкогольных напитков. Незначительные применения этиленгликоля включают производство конденсаторов, в качестве промежуточного химического вещества при производстве 1,4-диоксана и в качестве добавки для предотвращения коррозии в системах жидкостного охлаждения для персональных компьютеров. ХимияЭтиленгликоль также может использоваться в качестве защитной группы для карбонильных групп в органическом синтезе. Реакция кетона или альдегида с этиленгликолем с кислотным катализатором (например, п-толуолсульфокислота; BF 3 · Et 2 O) дает циклический ацеталь — 1,3-диоксолан, устойчивый к основаниям и другие нуклеофилы. После этого 1,3-диоксолановую защитную группу можно удалить, например, дальнейшим кислотным гидролизом. [3] В этом примере изофорон был защищен этиленгликолем с п-толуолсульфокислотой с умеренным выходом. Лабораторное использованиеЭтиленгликоль обычно используется в лабораториях для осаждения белков в растворе. Часто это промежуточный этап фракционирования, очистки и/или кристаллизации. Его можно использовать для защиты функциональных групп от реакции во время органического синтеза. Чтобы вернуть функциональной группе ее первоначальный состав, просто добавьте воду и кислоту. Этиленгликоль обычно используется в качестве консерванта для образцов в школах, часто во время вскрытия. Говорят, что он безопаснее формальдегида, но безопасность сомнительна. Другие примененияВысокая температура кипения этиленгликоля и его сродство к воде делают его идеальным осушителем для производства природного газа. В полевых условиях избыток водяного пара обычно удаляют путем дегидратации гликоля. Этиленгликоль стекает вниз с верхней части колонны и встречается снизу с восходящей смесью водяного пара и углеводородных газов. Вместо удаления воды этиленгликоль также можно использовать для снижения температуры, при которой образуются гидраты. Чистота гликоля, используемого для подавления образования гидратов (моноэтиленгликоль), обычно составляет около 80%, тогда как чистота гликоля, используемого для дегидратации (триэтиленгликоль), обычно составляет 95-99+%. Более того, скорость закачки для подавления гидратообразования намного ниже, чем скорость циркуляции в колонне осушки гликоля. Этиленгликоль также используется в производстве некоторых вакцин, но сам по себе он не присутствует в этих инъекциях. Он используется в качестве второстепенного (1–2%) ингредиента в креме для обуви, а также в некоторых чернилах и красках. ТоксичностьОсновная опасность этиленгликоля связана с проглатыванием. Из-за его сладкого вкуса дети и животные иногда потребляют его в больших количествах, если им предоставляется доступ к антифризу. Этиленгликоль также может быть обнаружен как загрязняющее вещество в самогоне, дистиллированном с использованием неправильно вымытого автомобильного радиатора. В развитых странах горький агент, называемый денатония/денатония бензоат, обычно добавляют к препаратам на основе этиленгликоля в качестве противодействующего фактора (для предотвращения случайного проглатывания). Если кто-то проглотил этиленгликоль, дайте ему алкогольный напиток, пока не прибудут фельдшеры. Этанол действует как конкурентный ингибитор активного центра фермента, который превращает этиленгликоль в его токсичные метаболиты. Отравление этиленгликолем требует неотложной медицинской помощи, и во всех случаях следует связаться с токсикологическим центром или обратиться за медицинской помощью. Он очень токсичен, расчетная LD 100 для человека составляет примерно 1,4 мл/кг. [5] Однако даже 30 миллилитров (2 столовые ложки) могут быть смертельными для взрослых. [6] СимптомыСимптомы отравления этиленгликолем обычно развиваются в три этапа, хотя у отравленных людей не всегда развивается каждая стадия или следуют определенные временные рамки. [5] Стадия 1 состоит из неврологических симптомов, в том числе жертв, которые выглядят опьяненными, с такими симптомами, как головокружение, головные боли, невнятная речь и спутанность сознания. Со временем организм метаболизирует этиленгликоль в другие токсины, сначала в гликолевый альдегид, который затем окисляется до гликолевой кислоты, глиоксиловой кислоты и, наконец, щавелевой кислоты. ЛечениеПервоначальное лечение состоит из стабилизации состояния пациента и обеззараживания желудка. Поскольку этиленгликоль быстро всасывается, обеззараживание желудка необходимо проводить вскоре после приема внутрь, чтобы оно принесло пользу. Промывание желудка или назогастральная аспирация желудочного содержимого являются наиболее распространенными методами, применяемыми при отравлении этиленгликолем. Рвота, вызванная ипекакуаном, или активированный уголь (уголь не адсорбирует гликоли) не рекомендуются. [5] Противоядиями при отравлении этиленгликолем являются этанол или фомепизол; антидотная терапия является основой лечения после приема внутрь. Помимо антидотов гемодиализ также может применяться для усиления выведения неметаболизированного этиленгликоля, а также его метаболитов из организма. Гемодиализ также имеет дополнительное преимущество, заключающееся в коррекции других метаболических нарушений или поддержке ухудшения функции почек, вызванного приемом внутрь этиленгликоля. Часто при лечении отравлений применяют вместе антидотную терапию и гемодиализ. Промышленные опасностиЭтиленгликоль может начать разлагаться при температуре 230–250 °F (110–121 °C). Обратите внимание, что поломка может произойти, когда объемная (средняя) температура системы ниже этих пределов, поскольку температура поверхности в теплообменниках и котлах может быть локально значительно выше этих температур. Электролиз растворов этиленгликоля с серебряным анодом приводит к экзотермической реакции. Пожарная катастрофа Аполлона-1 была вызвана этой реакцией. Смесь этиленгликоля и воды воспламенялась и могла гореть в атмосфере чистого кислорода низкого давления. [ ссылка необходима ] ИсторияЭтиленгликоль был впервые получен в 1859 году французским химиком Шарлем-Адольфом Вюрцем. Он производился в небольших количествах во время Первой мировой войны в качестве охлаждающей жидкости и ингредиента взрывчатых веществ. Широкое промышленное производство началось в 1937, когда оксид этилена, компонент его синтеза, стал дешево доступен. При первом появлении он произвел небольшую революцию в конструкции самолетов, поскольку при использовании вместо воды в качестве охлаждающей жидкости двигателя его более высокая температура кипения позволяла использовать радиаторы меньшего размера, работающие при более высоких температурах. До того, как этиленгликоль стал широко доступен, многие производители самолетов пытались использовать системы испарительного охлаждения, в которых использовалась вода под высоким давлением. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Эта статья находится под лицензией GNU Free Documentation License. Он использует материал из статьи Википедии «Этилен_гликоль». Список авторов есть в Википедии. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Этиленгликоль – свойства и применение
Этиленгликоль, относящийся к группе соединений, называемых гликолями, является популярным компонентом хладагентов благодаря своим превосходным свойствам теплопередачи. Гликоли используются в самых разных областях применения для нагрева и охлаждения, таких как системы отопления, вентиляции и кондиционирования воздуха, изготовление пластиковых форм, пищевые и фармацевтические процессы. В связи с широким применением этиленгликоля во многих областях стоит познакомиться с этим соединением и его свойствами поближе.
В связи с широким применением этиленгликоля во многих областях стоит познакомиться с этим соединением и его свойствами поближе.
Физико-химические свойства этиленгликоля
Этиленгликоль с формулой CH 2 OH 2 , также известный как 1,2-этандиол, является популярным органическим соединением. Паспорт безопасности на этиленгликоль, как и на другие вещества, является основным источником информации об их физических и химических свойствах. Этиленгликоль является основным компонентом антифризов в системах отопления, вентиляции и кондиционирования воздуха и автомобильных системах. Формула гликоля ясно указывает на то, что он принадлежит к химической группе дигидроксиспиртов, также известных как диолы. Таким образом, гликоль в виде спирта представляет собой бесцветную жидкость с высокой вязкостью и сладким вкусом. Помимо отличной смешиваемости с водой, он также хорошо растворяется в альдегидах, кетонах и уксусной кислоте, но совсем не растворяется в четыреххлористом углероде.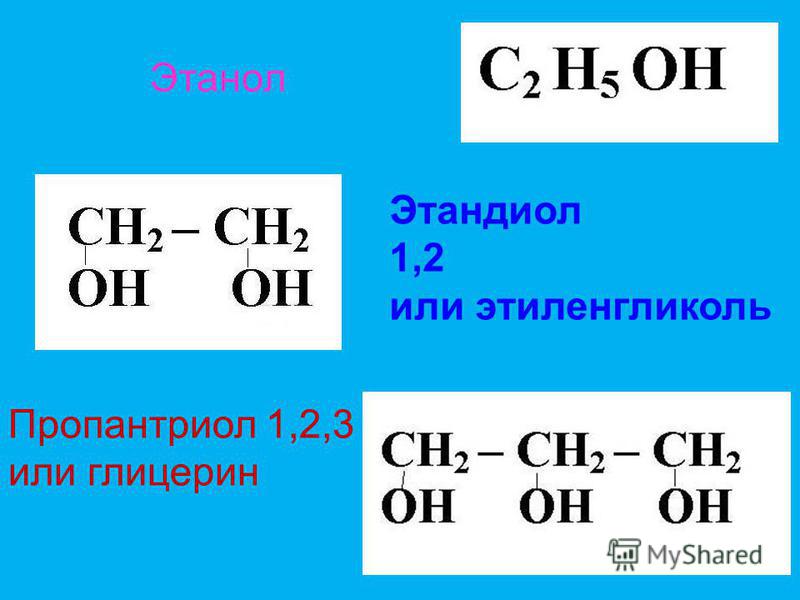 Он относительно дешев в производстве. Его недостатком является кристаллизация при низких температурах и более низкая (по сравнению с пропиленгликолем) способность к поглощению тепла (около 50% теплоемкости воды).
Он относительно дешев в производстве. Его недостатком является кристаллизация при низких температурах и более низкая (по сравнению с пропиленгликолем) способность к поглощению тепла (около 50% теплоемкости воды).
Этиленгликоль имеет высокую температуру кипения (197°C) при низкой молекулярной массе. Это связано с прочной ассоциацией молекул в жидкой фазе, вызванной образованием водородных связей. В чистом виде этиленгликоль замерзает примерно при -13°C, тогда как смесь этиленгликоля и воды может оставаться жидкой при гораздо более низких температурах. Например, смесь 40% воды и 60% гликоля может выдерживать температуры до -37°C. Следует отметить, что этиленгликоль смешивается с водой во всех соотношениях. Это связано с наличием в его структуре двух гидроксильных групп.
При просмотре литературы или предложений производителей можно встретить термин моноэтиленгликоль (МЭГ). Однако имейте в виду, что моноэтиленгликоль и этиленгликоль — это, по сути, одно и то же вещество.
Этиленгликоль – производство
Этиленгликоль, выпускаемый в промышленных масштабах, получают гидролизом окиси этилена, полученной при окислении этилена.
Производство окиси этилена
На первой стадии производства этиленгликоля в многоканальный реактор вводят этилен и кислород. Реакция протекает в газовой фазе в присутствии серебра в качестве катализатора на основе оксида алюминия. Реакция сильно экзотермична и выделяет большое количество тепла.
Производство и очистка этиленгликоля
Оксид этилена реагирует с CO 2 с образованием этиленкарбоната, который затем гидролизуется до этиленгликоля. Обе реакции проводят в жидкой фазе с использованием гомогенных кислотных катализаторов. Поток CO 2 с более ранних стадий реакции рециркулируют в реактор получения этиленкарбоната. Затем этиленгликоль очищают в двух дистилляционных колоннах, в которых из продукта удаляют воду. Катализатор отделяют и возвращают в замкнутые реакторы.
Этиленгликоль и пропиленгликоль – основные различия
Одним из основных различий между этиленгликолем и пропиленгликолем является уровень токсичности. Этиленгликоль токсичен, а пропиленгликоль — нет. В приложениях, где токсичность не имеет значения, этиленгликоль часто является лучшим выбором в качестве теплоносителя. Этиленгликоль не следует использовать, если есть вероятность его проглатывания или случайного контакта с пищей или питьевой водой. Его также не следует использовать в системах отопления или охлаждения в таких помещениях, как предприятия пищевой промышленности или другие предприятия, где производятся продукты, предназначенные для потребления. Когда требуется низкая токсичность, обычно используется пропиленгликоль из-за его низкой острой токсичности при пероральном введении.
Этиленгликоль токсичен, а пропиленгликоль — нет. В приложениях, где токсичность не имеет значения, этиленгликоль часто является лучшим выбором в качестве теплоносителя. Этиленгликоль не следует использовать, если есть вероятность его проглатывания или случайного контакта с пищей или питьевой водой. Его также не следует использовать в системах отопления или охлаждения в таких помещениях, как предприятия пищевой промышленности или другие предприятия, где производятся продукты, предназначенные для потребления. Когда требуется низкая токсичность, обычно используется пропиленгликоль из-за его низкой острой токсичности при пероральном введении.
Оба типа гликолей различаются по своим физическим свойствам. Их химические свойства также различны. Этиленгликоль широко используется там, где важна производительность и нет прямого контакта с людьми или животными. Этиленгликоль обладает отличной теплопроводностью и защитой от замерзания. Низкая вязкость гликоля способствует превосходной эффективности теплопередачи, а транспортные свойства превосходят пропиленгликоль при более низких температурах. Однако, поскольку пропиленгликоль имеет более высокую удельную теплоемкость, необходимо циркулировать больше этиленгликоля для передачи того же количества энергии, что и пропиленгликоль. Растворы пропиленгликоля имеют более высокую вязкость и температуру застывания, чем этиленгликоль при тех же условиях. Прежде всего, при более низких температурах пропиленгликоль термически менее эффективен, чем этиленгликоль.
Однако, поскольку пропиленгликоль имеет более высокую удельную теплоемкость, необходимо циркулировать больше этиленгликоля для передачи того же количества энергии, что и пропиленгликоль. Растворы пропиленгликоля имеют более высокую вязкость и температуру застывания, чем этиленгликоль при тех же условиях. Прежде всего, при более низких температурах пропиленгликоль термически менее эффективен, чем этиленгликоль.
Этиленгликоль – применение
В связи с широким использованием в автомобильной промышленности стоит задаться вопросом: что такое этиленгликоль и каковы его применение и свойства. Этиленгликоль широко используется во многих промышленных и коммерческих целях. Этот продукт также присутствует в ряде популярных бытовых товаров, таких как моющие средства, косметика, краски и растворители для пластмасс.
Другие области применения гликоля:
- производство стекловолокна для таких изделий, как водные скутеры, ванны и шары для боулинга.
- производство чернил для ручек и других видов чернил.
 Этиленгликоль повышает вязкость чернил и снижает вероятность их испарения.
Этиленгликоль повышает вязкость чернил и снижает вероятность их испарения.
- жидкие теплоносители, такие как промышленные охлаждающие жидкости для газовых компрессоров, систем отопления, вентиляции и кондиционирования воздуха, а также катков. Этиленгликоль придает промышленным охлаждающим жидкостям свойства, которые помогают им проходить через системы охлаждения и выдерживать экстремальные температуры.
Этиленгликоль в охлаждающих жидкостях
Благодаря свойствам этиленгликоль (помимо пропиленгликоля) является популярным компонентом охлаждающих жидкостей для двигателей внутреннего сгорания. Основная задача охлаждающей жидкости – эффективно собирать тепловую энергию двигателя и рассеивать ее через радиатор в окружающую среду. Таким образом, охлаждающая жидкость предотвращает замерзание двигателя зимой и в то же время действует как охлаждающая жидкость при высоких температурах летом. Помимо отвода тепла от двигателя охлаждающая жидкость должна выполнять ряд не менее важных функций, таких как:
- защита от замерзания – этиленгликоль в качестве компонента антифриза влияет на улучшение свойств теплопередачи, включая более низкую динамическую вязкость и более высокую теплопроводность
- защита от кавитации – охлаждающая жидкость создает эффективный защитный слой от замерзания, закипания и кавитации, предотвращая образование кавитационных ямок
- защита от коррозии различных элементов двигателя и всей системы охлаждения – этого можно добиться благодаря содержанию синергетических ингибиторов коррозии, защищающих металлы, которые обычно используются в системах данного типа.
 Это помогает обеспечить длительный срок службы и высокую тепловую эффективность
Это помогает обеспечить длительный срок службы и высокую тепловую эффективность
- защита от образования и отложения примесей в системе
Этиленгликоль как компонент антифризов обладает улучшенными свойствами теплопередачи, в том числе более низкой динамической вязкостью и более высокой теплопроводностью. Жидкости на основе этиленгликоля могут успешно использоваться в установках, изготовленных из металлов и их сплавов, таких как медь, латунь, сталь, чугун или алюминий. В таких системах охлаждения можно без проблем использовать все распространенные уплотнения.
Будущее охлаждающих жидкостей
Такие факторы, как растущий спрос на высокопроизводительные автомобили и более широкое использование высококачественных высокотехнологичных присадок, дополняют развитие мирового рынка автомобильных антифризов. Однако колебания цен на сырье (нефть) и растущий спрос на электромобили с питанием от аккумуляторов несколько сдерживают развитие этого сектора. Доступность новых экологически безопасных биотехнологических хладагентов и антифризов, несомненно, дополнит развитие рынка автомобильных антифризов в ближайшем будущем и повысит качество используемых в настоящее время.
Доступность новых экологически безопасных биотехнологических хладагентов и антифризов, несомненно, дополнит развитие рынка автомобильных антифризов в ближайшем будущем и повысит качество используемых в настоящее время.
Группа РСС предлагает этиленгликоль (CAS 9005-07-6). Доступный этиленгликоль действует как эмульгатор и смазочное масло, особенно в автомобильной промышленности. Это отличный компонент для производства охлаждающих жидкостей с особыми требованиями.
Вредность этиленгликоля
Этиленгликоль токсичен для человека и вызывает ряд физиологических проблем, включая смерть (по оценкам Центра контроля заболеваний, смертельная доза составляет от 1400 до 1600 мг/кг). Он всасывается через кожу (кожный путь), дыхательные и желудочно-кишечные тракты в организме человека. Следовательно, этиленгликоль не следует использовать там, где возможно загрязнение питьевой воды. Его также не следует использовать в системах отопления или охлаждения в таких помещениях, как предприятия пищевой промышленности или другие предприятия, где производятся продукты для потребления.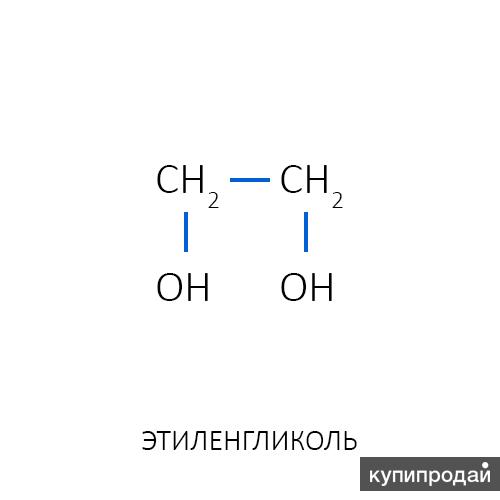
Пары этиленгликоля могут привести к потере сознания, а в низких концентрациях вызывают раздражение носа и горла. Гораздо более серьезными являются последствия приема внутрь этиленгликоля. Его токсичность в основном обусловлена накоплением токсичных метаболитов. Этиленгликоль оказывает сильное действие на центральную нервную систему (ЦНС). Оказывает острое действие, сходное с действием этанола. Это влияние на центральную нервную систему преобладает в первые часы после воздействия. Недиагностированное или нелеченое потребление этиленгликоля может привести к серьезным телесным повреждениям и даже смерти.
Этиленгликоль – часто задаваемые вопросы
- Можно ли смешивать этиленгликоль с пропиленгликолем?
Ответ на этот вопрос ищет каждый автовладелец, который задается вопросом, можно ли смешивать охлаждающие жидкости на основе разных гликолей. Этого делать не следует. В случае с этиленгликолем и пропиленгликолем основное различие заключается в плотности этих веществ.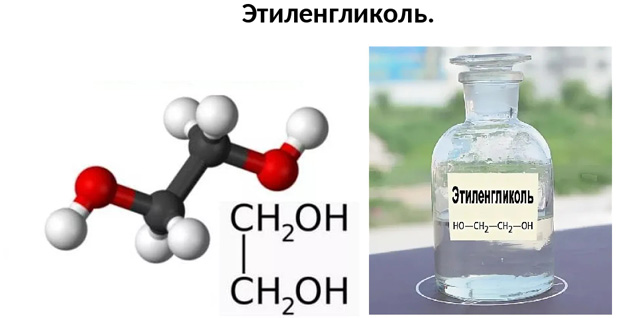 На практике измерить морозостойкость жидкости сложно, и это может обернуться неприятностями в зимнее время года.
На практике измерить морозостойкость жидкости сложно, и это может обернуться неприятностями в зимнее время года.
- Как отличить этиленгликоль от пропиленгликоля?
Существует метод различения этих двух гликолей. Он использует различия в физических свойствах, удельной плотности и показателе преломления между этиленом и пропиленгликолем. Последнее является очень полезным параметром для определения того, с какими отношениями мы имеем дело. Несколько капель вещества помещаются на призму специального прибора, так называемого рефрактометра, и считывают показатель преломления, что позволяет провести идентификацию.
- Чем этиленгликоль отличается от глицерина?
Оба соединения относятся к одной химической группе, т.е. к спиртам. Они отличаются количеством гидроксильных групп -ОН в молекуле. Глицерин является производным пропана (пропантриола), а этиленгликоль — производным этана (этандиола).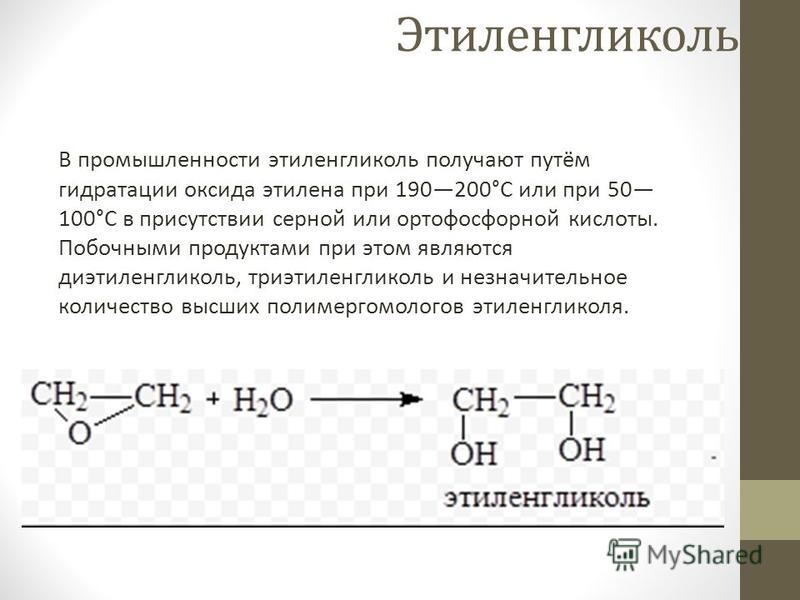 В водных растворах они понижают температуру замерзания, а также повышают температуру кипения. Имея выбор между глицерином и этиленгликолем, стоит подумать об использовании первого, потому что он более безопасен в использовании. Его негативное воздействие на окружающую среду также меньше.
В водных растворах они понижают температуру замерзания, а также повышают температуру кипения. Имея выбор между глицерином и этиленгликолем, стоит подумать об использовании первого, потому что он более безопасен в использовании. Его негативное воздействие на окружающую среду также меньше.
- Где можно купить этиленгликоль?
Этиленгликоль можно легко купить в химических магазинах или у оптовиков. Цена этого вещества находится в относительно широком диапазоне. Стоит обратить внимание на приобретение товара самого высокого качества. Этиленгликоль также входит в ассортимент реагентов, предлагаемых Группой PCC (номер CAS 9005-07-6).
- Отравление этиленгликолем – каковы симптомы?
Отравление этиленгликолем очень часто напоминает состояние алкогольного опьянения. Отмечается заметная бессвязность движений, сонливость, учащенное дыхание, повышение артериального давления и, в некоторых случаях, судороги.
 Монополия на такой способ производства сохранялась до 1953 года.
Монополия на такой способ производства сохранялась до 1953 года.
 В чистом виде это бесцветная сиропообразная жидкость без запаха со сладким вкусом. Этиленгликоль токсичен, и его случайное проглатывание требует неотложной медицинской помощи.
В чистом виде это бесцветная сиропообразная жидкость без запаха со сладким вкусом. Этиленгликоль токсичен, и его случайное проглатывание требует неотложной медицинской помощи.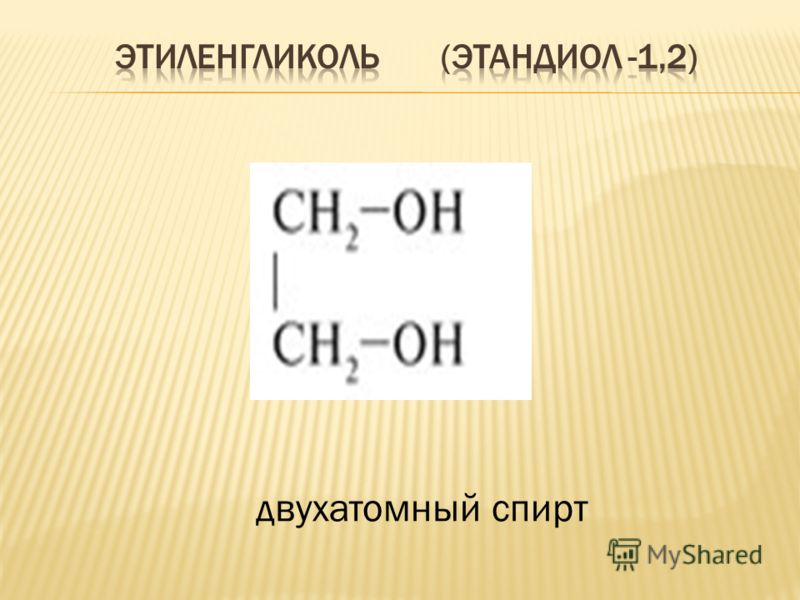 Наибольший выход этиленгликоля наблюдается при кислом или нейтральном рН с большим избытком воды. В этих условиях можно достичь выхода этиленгликоля 90%. Основными побочными продуктами являются олигомеры этиленгликоля, диэтиленгликоль, триэтиленгликоль и тетраэтиленгликоль.
Наибольший выход этиленгликоля наблюдается при кислом или нейтральном рН с большим избытком воды. В этих условиях можно достичь выхода этиленгликоля 90%. Основными побочными продуктами являются олигомеры этиленгликоля, диэтиленгликоль, триэтиленгликоль и тетраэтиленгликоль. Антифризные свойства этиленгликоля сделали его важным компонентом витрифицирующих смесей для низкотемпературной консервации биологических тканей и органов.
Антифризные свойства этиленгликоля сделали его важным компонентом витрифицирующих смесей для низкотемпературной консервации биологических тканей и органов.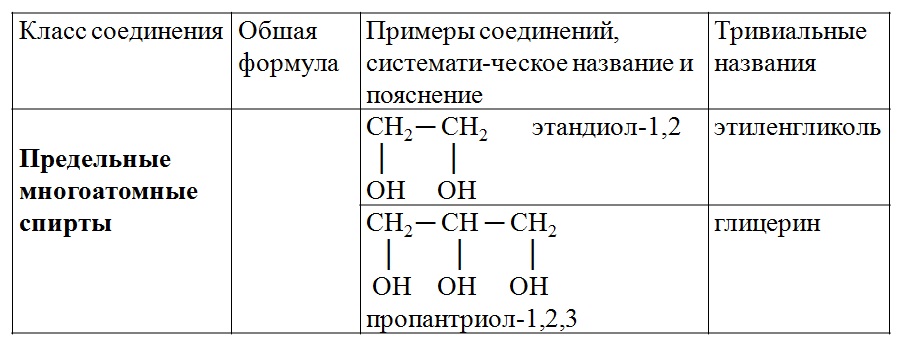 Воду удаляли азеотропной перегонкой, чтобы сместить равновесие вправо. [4]
Воду удаляли азеотропной перегонкой, чтобы сместить равновесие вправо. [4] Гликоль химически удаляет водяной пар, позволяя сухому газу выходить из верхней части колонны. Гликоль и вода разделяются, и гликоль снова проходит через колонну.
Гликоль химически удаляет водяной пар, позволяя сухому газу выходить из верхней части колонны. Гликоль и вода разделяются, и гликоль снова проходит через колонну.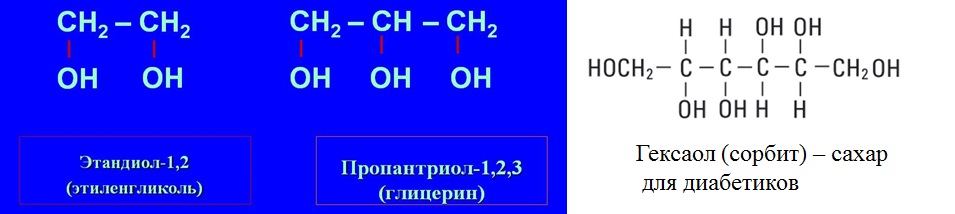 В некоторых случаях он использовался для обработки частично сгнивших деревянных предметов, которые будут выставлены в музеях. Это один из немногих методов лечения, которые успешно борются с гнилью в деревянных лодках и относительно дешевы.
В некоторых случаях он использовался для обработки частично сгнивших деревянных предметов, которые будут выставлены в музеях. Это один из немногих методов лечения, которые успешно борются с гнилью в деревянных лодках и относительно дешевы. Как только этанол связывается, этиленгликоль безвредно выводится из организма.
Как только этанол связывается, этиленгликоль безвредно выводится из организма. Стадия 2 является результатом накопления этих метаболитов и состоит из тахикардии, артериальной гипертензии, гипервентиляции и метаболического ацидоза. 3 стадия отравления этиленгликолем является результатом поражения почек, приводящего к острой почечной недостаточности. [7] Щавелевая кислота реагирует с кальцием и образует кристаллы оксалата кальция в почках.
Стадия 2 является результатом накопления этих метаболитов и состоит из тахикардии, артериальной гипертензии, гипервентиляции и метаболического ацидоза. 3 стадия отравления этиленгликолем является результатом поражения почек, приводящего к острой почечной недостаточности. [7] Щавелевая кислота реагирует с кальцием и образует кристаллы оксалата кальция в почках.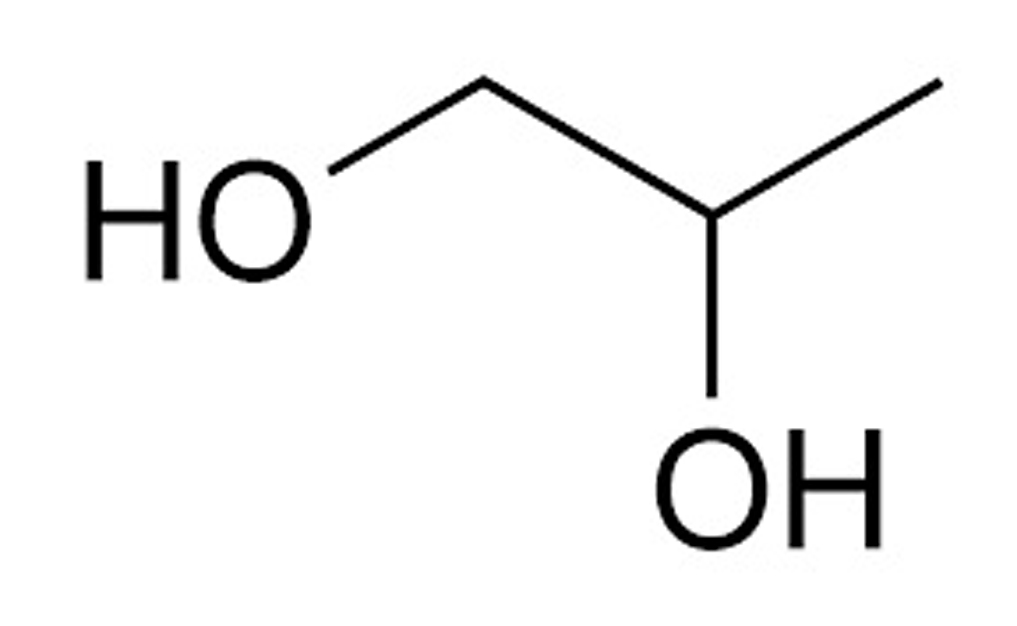 Этанол (обычно вводится внутривенно в виде 5- или 10-процентного раствора в 5-процентном растворе декстрозы и воде, но также иногда вводится в виде крепкого спирта, такого как виски, водка или джин) действует, конкурируя с этиленгликолем за фермент алкогольдегидрогеназу. тем самым ограничивая образование токсичных метаболитов. Фомепизол ингибирует алкогольдегидрогеназу, тем самым блокируя образование токсических метаболитов. [8]
Этанол (обычно вводится внутривенно в виде 5- или 10-процентного раствора в 5-процентном растворе декстрозы и воде, но также иногда вводится в виде крепкого спирта, такого как виски, водка или джин) действует, конкурируя с этиленгликолем за фермент алкогольдегидрогеназу. тем самым ограничивая образование токсичных метаболитов. Фомепизол ингибирует алкогольдегидрогеназу, тем самым блокируя образование токсических метаболитов. [8]
 Они неизменно оказывались довольно ненадежными и легко повреждались в бою, потому что занимали много места в самолете, где по ним легко стреляли.
Они неизменно оказывались довольно ненадежными и легко повреждались в бою, потому что занимали много места в самолете, где по ним легко стреляли. Этиленгликоль повышает вязкость чернил и снижает вероятность их испарения.
Этиленгликоль повышает вязкость чернил и снижает вероятность их испарения.
 Это помогает обеспечить длительный срок службы и высокую тепловую эффективность
Это помогает обеспечить длительный срок службы и высокую тепловую эффективность