Содержание
новые правила расчета стоимости, КБМ и возврат классов водителей
Артем Мазанов
будет оформлять ОСАГО
С 1 апреля вступили в силу пункты указания Центробанка, которые возвращают классы водителей при расчете стоимости ОСАГО и меняют коэффициенты, зависящие от безаварийной езды.
Что такое коэффициент бонус-малус, КБМ
В России запрещено ездить на автомобиле без ОСАГО. Страховку можно оформлять как на год, так и на меньший срок — если, например, вы пользуетесь автомобилем только в конкретный сезон. Стоимость полиса складывается из базового тарифа, умноженного на разные коэффициенты: территориальный, возраста, стажа и так далее.
На цену ОСАГО значительно влияет коэффициент бонус-малус, КБМ, который учитывает безаварийную езду. Если ДТП по вине водителя не было, полис стоит дешевле, если были — дороже. КБМ для каждого водителя обновляется ежегодно 1 апреля.
/guide/bonus-malus/
Как считается коэффициент бонус-малус
Посмотреть, из чего складывается стоимость вашего полиса, можно в самом документе.
Как было раньше
До 1 апреля 2019 года каждому водителю присваивался класс вождения. Начинающие водители получали класс 3. Он соответствовал базовому КБМ — 1. При безаварийной езде класс повышался на единицу в год, а КБМ понижался на 5%.
Максимально можно было получить 13-й класс — такой у самых аккуратных водителей. Еще был класс, который обозначался буквой, — М. Его присваивали тем, кто очень часто становился виновником ДТП. Такие водители оформляли полис по наибольшей стоимости.
После апреля 2019 года от классов водителей отказались. В таблице расчета КБМ остались только коэффициенты, но принцип их применения не изменился.
Что изменилось
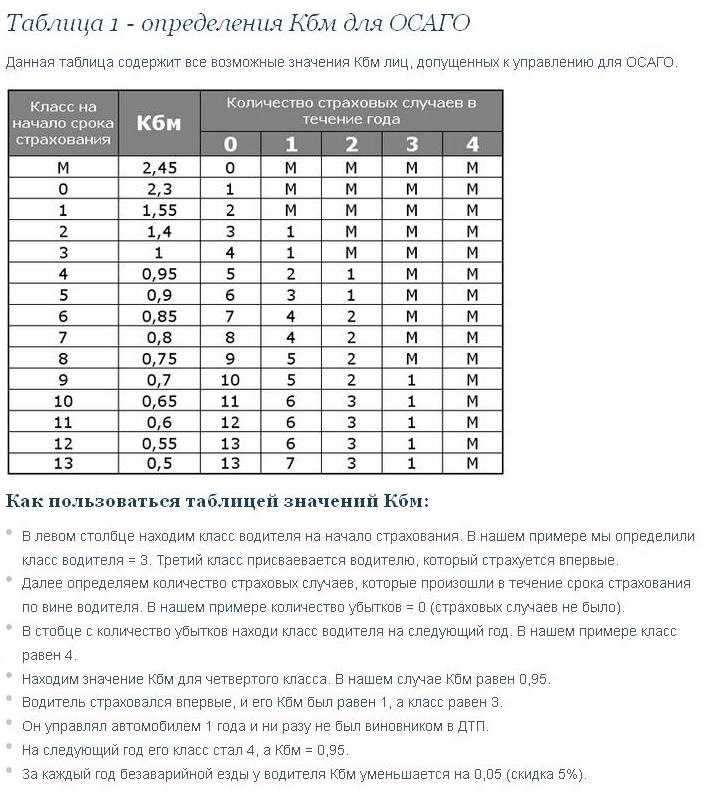
С 1 апреля 2022 года классы водителей вернули. Они будут соответствовать текущему КБМ. Проверить его можно на сайте Российского союза автостраховщиков.
Как изменился КБМ в 2022 году
| КБМ до 1 апреля | КБМ с 1 апреля | Класс водителя |
|---|---|---|
| 2,45 | 3,92 | М |
| 2,3 | 2,94 | 0 |
| 1,55 | 2,25 | 1 |
| 1,4 | 1,76 | 2 |
| 1 | 1,17 | 3 |
| 0,95 | 1 | 4 |
| 0,9 | 0,91 | 5 |
| 0,85 | 0,83 | 6 |
| 0,8 | 0,78 | 7 |
| 0,75 | 0,74 | 8 |
| 0,7 | 0,68 | 9 |
| 0,65 | 0,63 | 10 |
| 0,6 | 0,57 | 11 |
| 0,55 | 0,52 | 12 |
| 0,5 | 0,46 | 13 |
Класс водителя — М
КБМ до 1 апреля
2,45
КБМ с 1 апреля
3,92
Класс водителя — 0
КБМ до 1 апреля
2,3
КБМ с 1 апреля
2,94
Класс водителя — 1
КБМ до 1 апреля
1,55
КБМ с 1 апреля
2,25
Класс водителя — 2
КБМ до 1 апреля
1,4
КБМ с 1 апреля
1,76
Класс водителя — 3
КБМ до 1 апреля
1
КБМ с 1 апреля
1,17
Класс водителя — 4
КБМ до 1 апреля
0,95
КБМ с 1 апреля
1
Класс водителя — 5
КБМ до 1 апреля
0,9
КБМ с 1 апреля
0,91
Класс водителя — 6
КБМ до 1 апреля
0,85
КБМ с 1 апреля
0,83
Класс водителя — 7
КБМ до 1 апреля
0,8
КБМ с 1 апреля
0,78
Класс водителя — 8
КБМ до 1 апреля
0,75
КБМ с 1 апреля
0,74
Класс водителя — 9
КБМ до 1 апреля
0,7
КБМ с 1 апреля
0,68
Класс водителя — 10
КБМ до 1 апреля
0,65
КБМ с 1 апреля
0,63
Класс водителя — 11
КБМ до 1 апреля
0,6
КБМ с 1 апреля
0,57
Класс водителя — 12
КБМ до 1 апреля
0,55
КБМ с 1 апреля
0,52
Класс водителя — 13
КБМ до 1 апреля
0,5
КБМ с 1 апреля
0,46
Источник: Указание ЦБ о расчете тарифов ОСАГОPDF, 3,57 МБ
С 1 апреля также заработали новые коэффициенты бонус-малус. Их будут применять при расчете страховой премии по договорам, которые заключили до 31 марта 2023 года включительно.
Их будут применять при расчете страховой премии по договорам, которые заключили до 31 марта 2023 года включительно.
Базовый коэффициент увеличили с 1 до 1,17. Такой присваивают водителю-новичку, который впервые оформляет полис ОСАГО.
Минимальный коэффициент — для водителей, которые 10 лет не были виновниками ДТП, — уменьшили с 0,5 до 0,46. Этот лимит изменили впервые с момента появления ОСАГО в 2003 году. Максимальная скидка за езду без аварий теперь будет 54% вместо прежних 50%. Как пишет Российский союз автостраховщиков, при прочих равных цена полиса ОСАГО для безаварийного водителя снизится на 8% по сравнению с нынешней минимальной ценой для него же.
Максимальный коэффициент — для водителей, которые часто становятся виновниками ДТП, — повысили с 2,45 до 3,92.
Какой класс получит водитель в следующий период
| Класс в текущем полисе | В новом полисе, если в течение года не было страховых случаев | Был один случай | Два | Три | Четыре |
|---|---|---|---|---|---|
| М | 0 | М | М | М | М |
| 0 | 1 | М | М | М | М |
| 1 | 2 | М | М | М | М |
| 2 | 3 | 1 | М | М | М |
| 3 | 4 | 1 | М | М | М |
| 4 | 5 | 2 | 1 | М | М |
| 5 | 6 | 3 | 1 | М | М |
| 6 | 7 | 4 | 2 | М | М |
| 7 | 8 | 4 | 2 | М | М |
| 8 | 9 | 5 | 2 | М | М |
| 9 | 10 | 5 | 2 | 1 | М |
| 10 | 11 | 6 | 3 | 1 | М |
| 11 | 12 | 6 | 3 | 1 | М |
| 12 | 13 | 6 | 3 | 1 | М |
| 13 | 13 | 7 | 3 | 1 | М |
Класс водителя в текущем полисе — М
В новом полисе, если в течение года не было страховых случаев
Если был один случай
М
Четыре
М
Класс водителя в текущем полисе — 0
В новом полисе, если в течение года не было страховых случаев
1
Если был один случай
М
Четыре
М
Класс водителя в текущем полисе — 1
В новом полисе, если в течение года не было страховых случаев
2
Если был один случай
М
Четыре
М
Класс водителя в текущем полисе — 2
В новом полисе, если в течение года не было страховых случаев
3
Если был один случай
1
Четыре
М
Класс водителя в текущем полисе — 3
В новом полисе, если в течение года не было страховых случаев
4
Если был один случай
1
Четыре
М
Класс водителя в текущем полисе — 4
В новом полисе, если в течение года не было страховых случаев
5
Если был один случай
2
Четыре
М
Класс водителя в текущем полисе — 5
В новом полисе, если в течение года не было страховых случаев
6
Если был один случай
3
Четыре
М
Класс водителя в текущем полисе — 6
В новом полисе, если в течение года не было страховых случаев
7
Если был один случай
4
Четыре
М
Класс водителя в текущем полисе — 7
В новом полисе, если в течение года не было страховых случаев
8
Если был один случай
4
Четыре
М
Класс водителя в текущем полисе — 8
В новом полисе, если в течение года не было страховых случаев
9
Если был один случай
5
Четыре
М
Класс водителя в текущем полисе — 9
В новом полисе, если в течение года не было страховых случаев
10
Если был один случай
5
Четыре
М
Класс водителя в текущем полисе — 10
В новом полисе, если в течение года не было страховых случаев
11
Если был один случай
6
Четыре
М
Класс водителя в текущем полисе — 11
В новом полисе, если в течение года не было страховых случаев
12
Если был один случай
6
Четыре
М
Класс водителя в текущем полисе — 12
В новом полисе, если в течение года не было страховых случаев
13
Если был один случай
6
Четыре
М
Класс водителя в текущем полисе — 13
В новом полисе, если в течение года не было страховых случаев
13
Если был один случай
7
Четыре
М
Источник: Указание ЦБ о расчете тарифов ОСАГОPDF, 3,57 МБ
Что осталось как раньше
Принцип применения коэффициента бонус-малус не изменился: если по вине водителя не происходит ДТП, то при следующем оформлении полиса он перемещается на одну строку вниз. А значит, при прочих равных полис обойдется ему дешевле.
А значит, при прочих равных полис обойдется ему дешевле.
Как устроено ОСАГО
Новости, которые касаются всех, — в нашем телеграм-канале. Подписывайтесь, чтобы быть в курсе происходящего: @tinkoffjournal.
Увеличение коэффициента КБМ при расчете ОСАГО с 1 апреля 2022 года
Добрый день, уважаемый читатель.
В предшествующей статье на ПДД Мастер рассмотрено новое Указание Банка России «О страховых тарифах по обязательному страхованию гражданской ответственности владельцев транспортных средств», которое начало действовать с 9 января 2022 года.
Напомню, что данный документ установил новые базовые тарифы, а также новые таблицы коэффициентов КТ, КО и КВС.
Сегодня речь пойдет о второй части нового Указания, которая вступает в силу с 1 апреля 2022 года и устанавливает новые коэффициенты КБМ, то есть коэффициенты, зависящие от безаварийной езды водителя:
- Информация о нормативном документе.
- Возвращение классов водителей с 1 апреля 2022 года.

- Новая таблица коэффициентов КБМ с 1 апреля 2022 года.
- Есть ли смысл покупать страховку до 1 апреля 2022 года?
Информация о нормативном документе
2022.01.14 Указание Банка России «О страховых тарифах по обязательному страхованию гражданской ответственности владельцев транспортных средств» опубликовано на официальном сайте Банка России 29 декабря 2021 года. Документ вступил в силу с 9 января 2022 года, однако некоторые его пункты начнут действовать только с 1 апреля 2022 года.
Источник: https://cbr.ru/press/event/?id=12589
Примечание. В данной статье рассматриваются только нововведения от 1 апреля 2022 года.
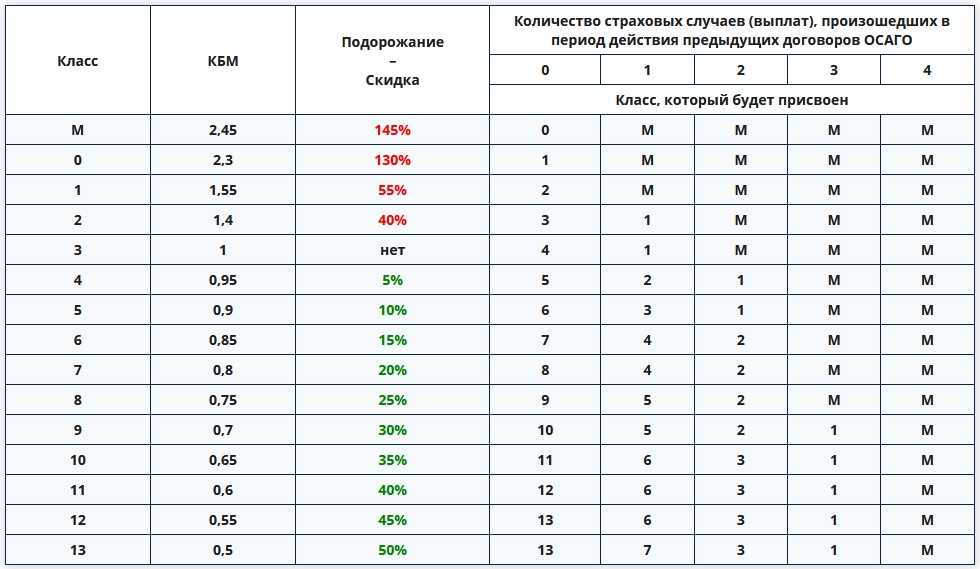
Возвращение классов водителей с 1 апреля 2022 года
Для начала немного истории. До 1 апреля 2019 года каждому водителю в России присваивался некоторый класс. Начинающий водитель получал класс 3, после чего каждый год безаварийного вождения увеличивал класс водителя на 1. Максимальное значение класса было равно 13. Чем выше был класс водителя, тем меньше становился его коэффициент безаварийного вождения (КБМ) и тем дешевле для водителя стоил страховой полис ОСАГО. Таблица, которая использовалась до 1 апреля 2019 года, приведена в следующем нормативном документе.
Чем выше был класс водителя, тем меньше становился его коэффициент безаварийного вождения (КБМ) и тем дешевле для водителя стоил страховой полис ОСАГО. Таблица, которая использовалась до 1 апреля 2019 года, приведена в следующем нормативном документе.
С 1 апреля 2019 года законодатели по каким-то причинам решили отказаться от понятия «класс водителя», то есть просто исключили его из таблицы. Сама таблица осталась прежней, однако ориентироваться в ней приходилось только по значению КБМ.
С 1 апреля 2022 года нас ждет обратное изменение законодательства, то есть понятие «класс КБМ» вновь возвращается в Указание Банка России. Соответствие между текущим КБМ водителя и классом водителя определяется с помощью следующей таблицы:
6. Соответствие коэффициента страховых тарифов в зависимости от количества произведенных страховщиками страховых возмещений в предшествующие периоды (далее — коэффициент КБМ), определенного на период с 1 апреля 2021 года по 31 марта 2022 года, классу КБМ на 31 марта 2022 года определяется в соответствии с приложением 6 к настоящему Указанию.
| N п/п | Класс КБМ на 31 марта 2022 года | Коэффициент КБМ на период КБМ с 1 апреля 2021 года по 31 марта 2022 года |
| 1 | 2 | 3 |
| 1 | М | 2,45 |
| 2 | 0 | 2,3 |
| 3 | 1 | 1,55 |
| 4 | 2 | 1,4 |
| 5 | 3 | 1 |
| 6 | 4 | 0,95 |
| 7 | 5 | 0,9 |
| 8 | 6 | 0,85 |
| 9 | 7 | 0,8 |
| 10 | 8 | 0,75 |
| 11 | 9 | 0,7 |
| 12 | 10 | 0,65 |
| 13 | 11 | 0,6 |
| 14 | 12 | 0,55 |
| 15 | 13 | 0,5 |
Внимательный читатель легко заметит, что с 1 апреля 2022 года возвращаются те же самые классы, которые использовались до 1 апреля 2019 года.
Так что остается лишь вопрос по поводу того, для чего эти классы вообще отменяли в 2019 году.
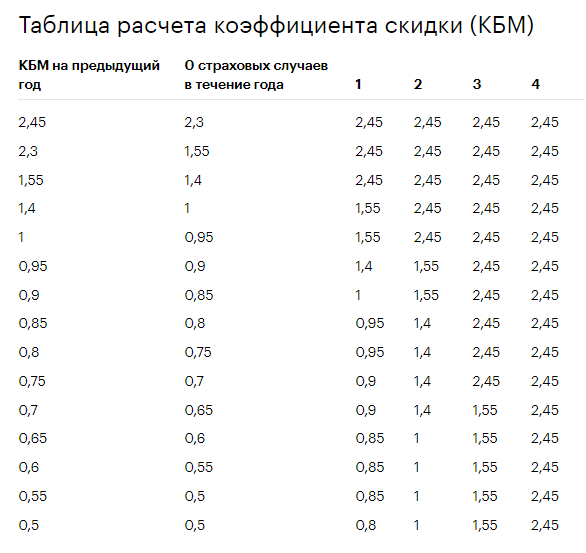
Новая таблица коэффициентов КБМ с 1 апреля 2022 года
Второе важное изменение, которое ожидает автовладельцев с 1 апреля 2022 года, — это введение новой таблицы с коэффициентами КБМ:
| N п / п |
Коэффициент КБМ на период КБМ | Коэффициент КБМ | ||||
| отстутствие страховых возмещений за период КБМ | одно страховое возмещение за период КБМ | два страховых возмещения за период КБМ | три страховых возмещения за период КБМ | более 3 страховых возмещений за период КБМ | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 1 | 2,45 | 2,3 | 2,45 | 2,45 | 2,45 | 2,45 |
| 2 | 2,3 | 1,55 | 2,45 | 2,45 | 2,45 | 2,45 |
| 3 | 1,55 | 1,4 | 2,45 | 2,45 | 2,45 | 2,45 |
| 4 | 1,4 | 1 | 1,55 | 2,45 | 2,45 | 2,45 |
| 5 | 1 | 0,95 | 1,55 | 2,45 | 2,45 | 2,45 |
| 6 | 0,95 | 0,9 | 1,4 | 1,55 | 2,45 | 2,45 |
| 7 | 0,9 | 0,85 | 1 | 1,55 | 2,45 | 2,45 |
| 8 | 0,85 | 0,8 | 0,95 | 1,4 | 2,45 | 2,45 |
| 9 | 0,8 | 0,75 | 0,95 | 1,4 | 2,45 | 2,45 |
| 10 | 0,75 | 0,7 | 0,9 | 1,4 | 2,45 | 2,45 |
| 11 | 0,7 | 0,65 | 0,9 | 1,4 | 1,55 | 2,45 |
| 12 | 0,65 | 0,6 | 0,85 | 1 | 1,55 | 2,45 |
| 13 | 0,6 | 0,55 | 0,85 | 1 | 1,55 | 2,45 |
| 14 | 0,55 | 0,5 | 0,85 | 1 | 1,55 | 2,45 |
| 15 | 0,5 | 0,5 | 0,8 | 1 | 1,55 | 2,45 |
| N п / п |
Класс КБМ на период КБМ | Коэффициент КБМ на период КБМ | Класс КБМ | ||||
| отсутствие страховых возмещений за период КБМ | одно страховое возмещение за период КБМ | два страховых возмещения за период КБМ | три страховых возмещения за период КБМ | более трех страховых возмещений за период КБМ | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 1 | М | 3,92 | 0 | М | М | М | М |
| 2 | 0 | 2,94 | 1 | М | М | М | М |
| 3 | 1 | 2,25 | 2 | М | М | М | М |
| 4 | 2 | 1,76 | 3 | 1 | М | М | М |
| 5 | 3 | 1,17 | 4 | 1 | М | М | М |
| 6 | 4 | 1 | 5 | 2 | 1 | М | М |
| 7 | 5 | 0,91 | 6 | 3 | 1 | М | М |
| 8 | 6 | 0,83 | 7 | 4 | 2 | М | М |
| 9 | 7 | 0,78 | 8 | 4 | 2 | М | М |
| 10 | 8 | 0,74 | 9 | 5 | 2 | М | М |
| 11 | 9 | 0,68 | 10 | 5 | 2 | 1 | М |
| 12 | 10 | 0,63 | 11 | 6 | 3 | 1 | М |
| 13 | 11 | 0,57 | 12 | 6 | 3 | 1 | М |
| 14 | 12 | 0,52 | 13 | 6 | 3 | 1 | М |
| 15 | 13 | 0,46 | 13 | 7 | 3 | 1 | М |
Если изучить пять правых столбцов таблицы, показывающих взаимосвязь между количеством страховых возмещений и коэффициентом КБМ водителя на следующий год, то можно понять, что они никак не изменились:
- если по вине водителя не происходит ни одного ДТП, то водитель перемещается на одну строку вниз;
- если по вине водителя происходят ДТП, то он перемещается на несколько строк вверх.

Однако изменения затронули значения коэффициентов в третьем столбце таблицы (в старой таблице — втором):
- коэффициент КБМ увеличится для водителей из верхней половины таблицы, то есть для тех, кто либо имеет менее 3-х лет безаварийного вождения, либо ранее стал виновником ДТП.
- коэффициент КБМ уменьшится для водителей, класс которых 6 или более (3 года безаварийного стажа для начинающего водителя).
На основании таблицы можно сделать следующие выводы:
- больше всего страховка подорожает для водителей, имеющих класс М, то есть ставших виновниками как минимум двух ДТП, — на 60 %.
- для начинающих водителей, имеющих класс 3, стоимость страховки также возрастет довольно существенно, — на 17 %.
- для опытных водителей, имеющих 10 или более лет безаварийной езды, страховка подешевеет больше всего — на 8 %.
С одной стороны, очевидно, что в среднем стоимость страховых полисов с 1 апреля 2022 года станет больше. С другой стороны, обновленная таблица КБМ будет дополнительным стимулом для водителя к соблюдению правил дорожного движения.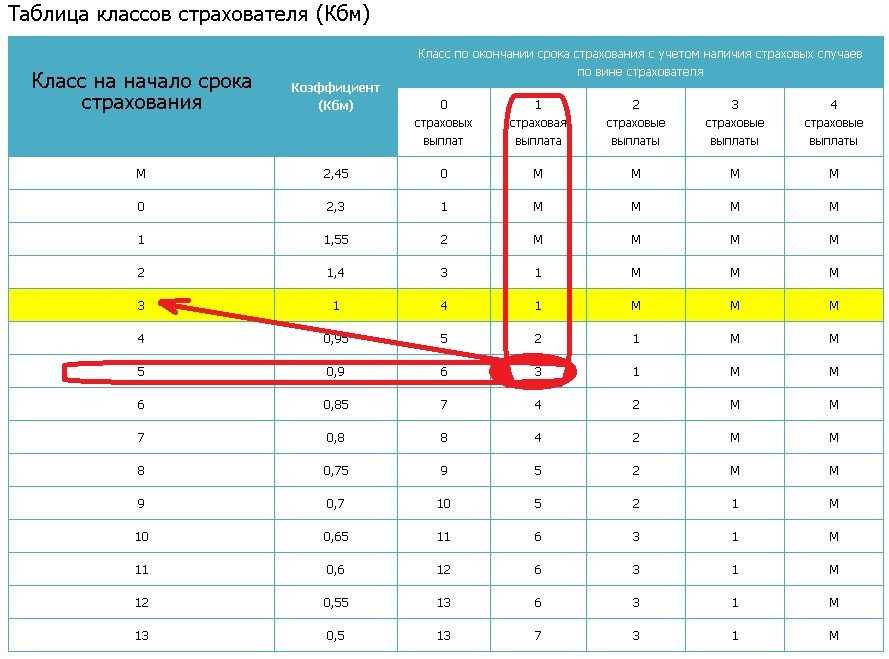
Есть ли смысл покупать страховку до 1 апреля 2022 года?
Поскольку с 1 апреля коэффициенты КБМ для некоторых водителей увеличатся, у многих возникает вопрос по поводу того, имеет ли смысл покупать страховой полис заранее, то есть до 1 апреля 2022 года. Особенно сильно этот вопрос волнует тех, у кого текущий полис заканчивается в самом начале апреля.
Поэтому разберемся, есть ли смысл в преждевременной покупке страховки.
Если в текущем страховом полисе самое большое значение КБМ среди водителей равно 2,3, 1,4, 1,0 или меньше, то преждевременная покупка страховки не имеет смысла, т.к. КБМ после 1 апреля уменьшится.
Остались еще 2 коэффициента КБМ 2,45 (класс М) и 1,55 (класс 1), которые заслуживают более подробного обсуждения.
Если водитель до 1 апреля 2022 года имеет КБМ равный 2,45, то даже при отсутствии ДТП по его вине после 1 апреля значение КБМ составит 2,94. То есть страховка подорожает на 2,94/2,45 * 100 = 1,2, то есть на 20%.
20 процентов — это стоимость страховки за 73 дня. Так что, если текущая страховка водителя заканчивается до 12 июня, то покупка новой страховки ОСАГО до 1 апреля может оказаться выгодной.
Если водитель до 1 апреля 2022 года имеет КБМ равный 1,55, то даже при отсутствии ДТП по его вине после 1 апреля значение КБМ составит 1,76. То есть страховка подорожает на 1,76/1,55 * 100 = 1,135, то есть на 13,5%.
13,5 процентов — это стоимость страховки за 49 дней. Так что, если текущая страховка водителя заканчивается до 19 мая, то покупка новой страховки ОСАГО до 1 апреля может оказаться выгодной.
Из этих расчетов можно сделать такой вывод. Если в текущей страховке максимальный КБМ водителей равен 2,45 или 1,55, а сам страховой полис заканчивается в начале апреля, то имеет смысл продлить страховку заранее, т.к. это принесет небольшую выгоду. Естественно, оформлять новый полис выгоднее всего с самого последнего дня, то есть с 31 марта.
Ну а в заключение предлагаю Вам изучить полный текст нового Указания Банка России:
Удачи на дорогах!
Об авторе:
Максим Калашников
—
эксперт по автомобильному законодательству России. Более 11 лет занимается изучением автомобильных нормативных документов и консультациями водителей. Автор аналитических статей и обучающих курсов. Руководитель проекта ПДД Мастер (pddmaster.ru).
Более 11 лет занимается изучением автомобильных нормативных документов и консультациями водителей. Автор аналитических статей и обучающих курсов. Руководитель проекта ПДД Мастер (pddmaster.ru).
Целлюлазные линкеры
оптимизированы на основе типа домена и функции: результаты анализа последовательностей, биофизических измерений и молекулярного моделирования
1.
Apic G, Huber W, Teichmann SA (2003)Многодоменные белковые семейства и пары доменов: сравнение с известными структурами и случайной моделью рекомбинации доменов. Журнал структурной и функциональной геномики
4: 67–78. [PubMed] [Google Scholar]
2.
Gonfloni S, Frischknecht F, Way M, Superti-Furga G (1999) Лейцин 255 Src связывает внутримолекулярные взаимодействия с ингибированием катализа. Структурная биология природы
6: 760–764. [PubMed] [Академия Google]
3.
Лафевр-Бернт М., Сичери Ф., Пико А., Портер М., Куриян Дж. и др. (1998) Внутримолекулярные регуляторные взаимодействия в киназах семейства Src Hck исследованы путем мутагенеза консервативного остатка триптофана.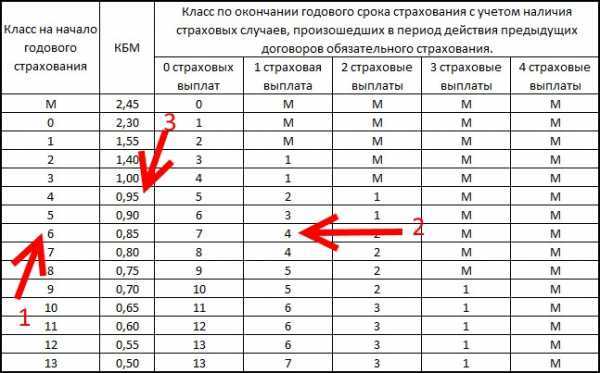 Журнал биологической химии
Журнал биологической химии
273: 32129–32134. [PubMed] [Google Scholar]
4.
Briggs SD, Smithgall TE (1999) Мутации линкера Sh3-киназы высвобождают тирозинкиназу Hck и трансформируют активность в фибробластах Rat-2. Журнал биологической химии
274: 26579–26583. [PubMed] [Академия Google]
5.
Чонг П.А., Лин Х., Врана Дж.Л., Форман-Кей Дж.Д. (2010)Связывание тандемных доменов регуляторного фактора убиквитинирования Smad (Smurf) WW модулирует специфичность мишени. Труды Национальной академии наук Соединенных Штатов Америки
107: 18404–18409. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6.
Shastry S, Hancock WO (2010)Длина линкера шеи определяет степень процессивности моторов кинезина-1 и кинезина-2. Текущая биология: CB
20: 939–943. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7.
Robinson CR, Sauer RT (1998) Оптимизация стабильности одноцепочечных белков путем мутагенеза длины и состава линкера. Труды Национальной академии наук Соединенных Штатов Америки
95: 5929–5934. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
8.
Сонан Г.К., Ресевер-Брешот В., Дуэз С., Агаджари Н., Чежек М. и др. (2007) Линкерная область играет ключевую роль в адаптации к холоду целлюлазы антарктической бактерии. Биохимический журнал
407: 293–302. [Бесплатная статья PMC] [PubMed] [Google Scholar]
9.
Harrison SC, Olson AJ, Schutt CE, Winkler FK, Bricogne G (1978) Вирус кустистости томатов с разрешением 2,9 A. Природа
276: 368–373. [PubMed] [Google Scholar]
10.
Alfthan K, Takkinen K, Sizmann D, Soderlund H, Teeri TT (1995) Свойства одноцепочечного антитела, содержащего различные линкерные пептиды. Белковая инженерия
8: 725–731. [PubMed] [Google Scholar]
11.
Хенкель Т., Забель У., ван Зее К., Мюллер Дж. М., Фаннинг Э. и др. (1992) Внутримолекулярное маскирование сигнала ядерной локации и домена димеризации в предшественнике субъединицы p50 NF-каппа B. Клетка
68: 1121–1133. [PubMed] [Google Scholar]
12.
Arai R, Wriggers W, Nishikawa Y, Nagamune T, Fujisawa T (2004)Конформации вариабельно связанных химерных белков, оцененные с помощью малоуглового рассеяния синхротронного рентгеновского излучения. Белки
Белки
57: 829–838. [PubMed] [Google Scholar]
13.
Yuzawa S, Kapur S, Cane DE, Khosla C (2012)Роль консервативного остатка аргинина в линкерах между доменами кетосинтазы и ацилтрансферазы мультимодульных поликетидсинтаз. Биохимия
51: 3708–3710. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14.
Tang Y, Chen AY, Kim CY, Cane DE, Khosla C (2007)Структурный и механистический анализ белковых взаимодействий в модуле 3 6-дезоксиэритронолид-B-синтазы. Химия и биология
14: 931–943. [Бесплатная статья PMC] [PubMed] [Google Scholar]
15.
Lin SC, Liu WT, Liu SH, Chou WI, Hsiung BK, et al. (2007) Роль линкерной области в экспрессии глюкоамилазы Rhizopus oryzae. Биохимия BMC
8: 9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16.
Густавссон М., Лехтио Дж., Денман С., Тири Т.Т., Халт К. и др. (2001)Стабильные линкерные пептиды для слитого белка целлюлозосвязывающего домена и липазы, экспрессированного в Pichia pastoris. Белковая инженерия
14: 711–715. [PubMed] [Академия Google]
17.
Ма Б., Цай С.Дж., Халилоглу Т., Нуссинов Р. (2011)Динамическая аллостерия: линкеры не просто гибкие. Структура
19: 907–917. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18.
Schmuck M, Pilz I, Hayn M, Esterbauer H (1986) Исследование целлобиогидролазы из Trichoderma-Reesei с помощью малоуглового рассеяния рентгеновских лучей. Письма по биотехнологии
8: 397–402. [Google Scholar]
19.
Abuja PM, Pilz I, Tomme P, Claeyssens M (1989)Структурные изменения в целлобиогидролазе I при связывании макромолекулярного лиганда, как видно из исследований SAXS. Коммуникации в области биохимических и биофизических исследований
165: 615–623. [PubMed] [Академия Google]
20.
Abuja PM, Schmuck M, Pilz I, Tomme P, Claeyssens M, et al. (1988) Структурные и функциональные домены целлобиогидролазы-I из Trichoderma-Reesei — исследование рассеяния рентгеновских лучей под малым углом интактного фермента и его ядра. Европейский журнал биофизики с письмами по биофизике
15: 339–342. [Google Scholar]
21.
Crasto CJ, Feng JA (2000) LINKER: программа для создания линкерных последовательностей для слитых белков. Белковая инженерия
13: 309–312. [PubMed] [Google Scholar]
22.
Уверский В.Н., Дункер А.К. (2012)Многопараметрический анализ внутренне неупорядоченных белков: взгляд на внутреннюю неупорядоченность через сложные глаза. Аналитическая химия
84: 2096–2104. [PubMed] [Google Scholar]
23.
Romero P, Obradovic Z, Li X, Garner EC, Brown CJ, et al. (2001)Сложность последовательности неупорядоченного белка. Белки
42: 38–48. [PubMed] [Google Scholar]
24.
Ван М., Курланд К.Г., Каэтано-Аноллес Г. (2011)Редуктивная эволюция протеомов и белковых структур. Труды Национальной академии наук Соединенных Штатов Америки
108: 11954–11958. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25.
Браун С.Дж., Джонсон А.К., Додрилл Г.В. (2010) Сравнение моделей эволюции упорядоченных и неупорядоченных белков. Мол Биол Эвол
27: 609–621. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26.
Чжан Дж. (2000) Распределение длины белка для трех областей жизни. Тенденции Жене
16: 107–109. [PubMed] [Google Scholar]
27.
Броккьери Л., Карлин С. (2005) Длина белка в эукариотических и прокариотических протеомах. Исследование нуклеиновых кислот
33: 3390–3400. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28.
Лян П., Райли М. (2001) Сравнительный геномный подход к изучению белков предков и эволюции. Достижения в области прикладной микробиологии
50: 39–72. [PubMed] [Google Scholar]
29.
Цуцуми С., Моллапур М., Продромоу С., Ли К.Т., Панаретоу Б. и др. (2012)Последовательность заряженного линкера модулирует активность шаперона эукариотического белка теплового шока 90 (Hsp90). Труды Национальной академии наук Соединенных Штатов Америки
109: 2937–2942. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30.
Kraulis J, Clore GM, Nilges M, Jones TA, Pettersson G, et al. (1989) Определение трехмерной структуры раствора С-концевого домена целлобиогидролазы I из Trichoderma reesei.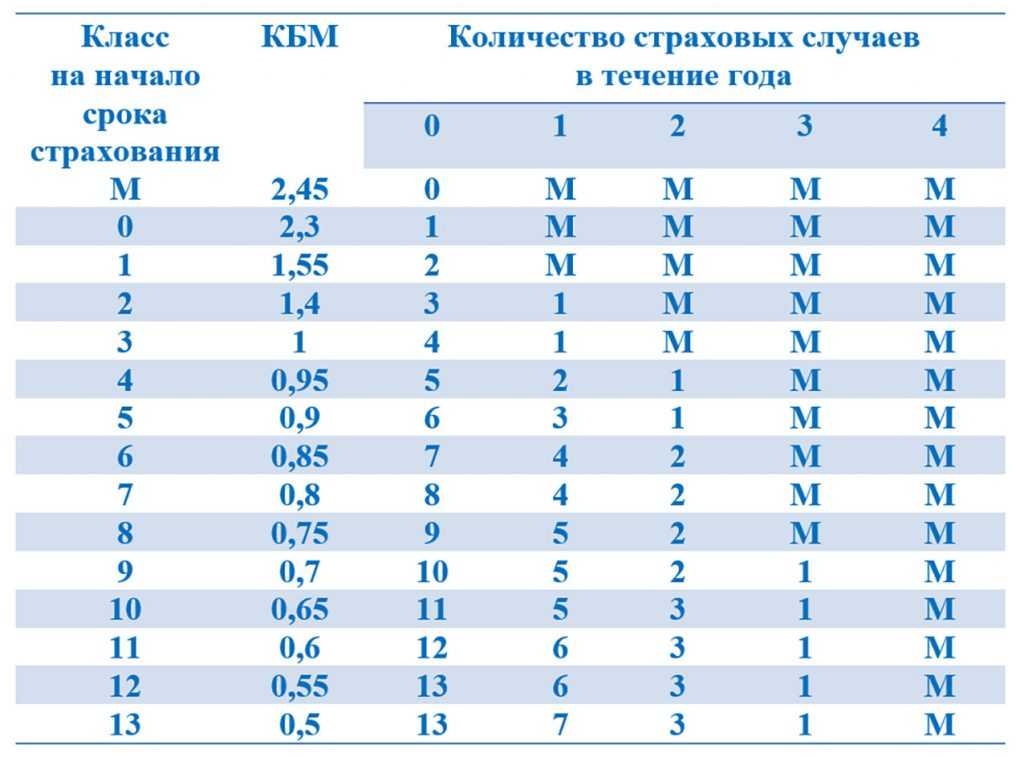 Исследование с использованием ядерного магнитного резонанса и гибридного дистанционно-геометрического отжига, моделирующего динамическое моделирование. Биохимия
Исследование с использованием ядерного магнитного резонанса и гибридного дистанционно-геометрического отжига, моделирующего динамическое моделирование. Биохимия
28: 7241–7257. [PubMed] [Академия Google]
31.
Борастон А.Б., Болам Д.Н., Гилберт Х.Дж., Дэвис Г.Дж. (2004)Модули связывания углеводов: точная настройка распознавания полисахаридов. Биохимический журнал
382: 769–781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32.
Дэвис Г., Хенриссат Б. (1995) Структуры и механизмы гликозилгидролаз. Структура
3: 853–859. [PubMed] [Google Scholar]
33.
Gilkes NR, Warren RA, Miller RC Jr, Kilburn DG (1988) Точное удаление целлюлозосвязывающих доменов из двух целлюлаз Cellulomonas fimi с помощью гомологичной протеазы и влияние на катализ. Журнал биологической химии
263: 10401–10407. [PubMed] [Академия Google]
34.
Томм П., Ван Тилбер Х., Петтерссон Г., Ван Дамм Дж., Вандекеркхов Дж. и др. (1988) Исследования целлюлолитической системы Trichoderma reesei QM 9414. Анализ функции домена в двух целлобиогидролазах путем ограниченного протеолиза. Европейский журнал биохимии/FEBS
Анализ функции домена в двух целлобиогидролазах путем ограниченного протеолиза. Европейский журнал биохимии/FEBS
170: 575–581. [PubMed] [Google Scholar]
35.
Срисодсук М., Рейникайнен Т., Пенттила М., Теери Т.Т. (1993)Роль междоменного линкерного пептида целлобиогидролазы I Trichoderma reesei во взаимодействии с кристаллической целлюлозой. Журнал биологической химии
268: 20756–20761. [PubMed] [Академия Google]
36.
Shen H, Schmuck M, Pilz I, Gilkes NR, Kilburn DG, et al. (1991) Делеция линкера, соединяющего каталитический и целлюлозосвязывающий домены эндоглюканазы А (CenA) Cellulomonas fimi, изменяет ее конформацию и каталитическую активность. Журнал биологической химии
266: 11335–11340. [PubMed] [Google Scholar]
37.
Abuja PM, Pilz I, Claeyssens M, Tomme P (1988)Доменная структура целлобиогидролазы II, изученная с помощью малоуглового рассеяния рентгеновских лучей: близкое сходство с целлобиогидролазой I. Сообщения о биохимических и биофизических исследованиях.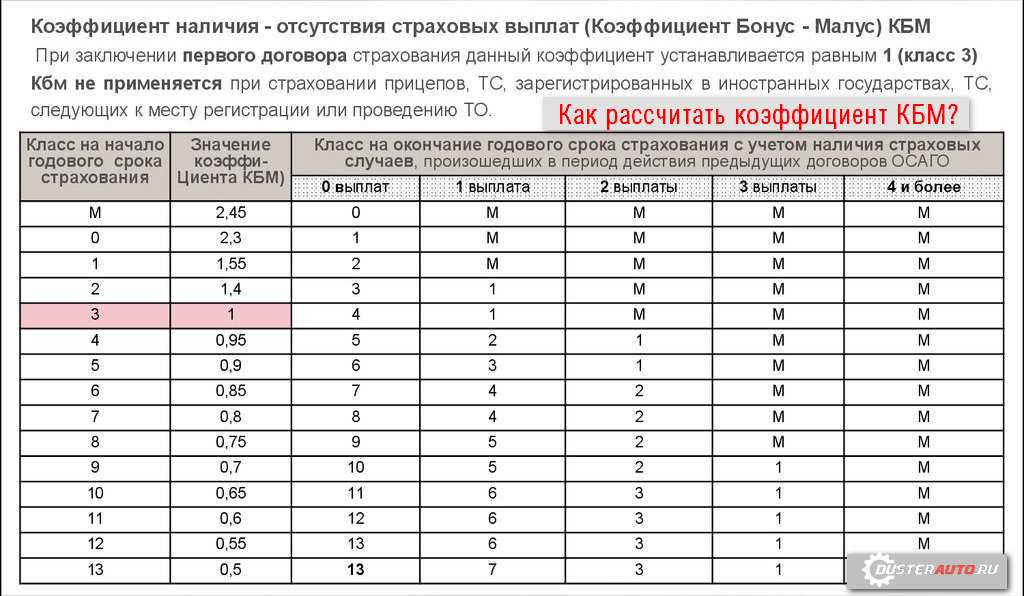 156: 180–185. [PubMed] [Академия Google]
156: 180–185. [PubMed] [Академия Google]
38.
Hui JP, White TC, Thibault P (2002)Идентификация структуры гликанов и сайтов гликозилирования в целлобиогидролазе II и эндоглюканазах I и II из Trichoderma reesei. гликобиология
12: 837–849. [PubMed] [Google Scholar]
39.
Harrison MJ, Nouwens AS, Jardine DR, Zachara NE, Gooley AA, et al. (1998) Модифицированное гликозилирование целлобиогидролазы I из мутантного штамма Trichoderma reesei с высоким уровнем продукции целлюлазы. Европейский журнал биохимии/FEBS
256: 119–127. [PubMed] [Академия Google]
40.
Recever V, Czjzek M, Schulein M, Panine P, Henrissat B (2002)Размер, форма и конформационная гибкость двухдоменной грибковой целлюлазы в растворе, исследованные с помощью малоуглового рассеяния рентгеновских лучей. Журнал биологической химии
277: 40887–40892. [PubMed] [Google Scholar]
41.
Hui JPM, Lanthier P, White TC, McHugh SG, Yaguchi M, et al. (2001) Характеристика гликоформ целлобиогидролазы I (Cel7A) из экстрактов Trichoderma reesei с использованием капиллярного изоэлектрического фокусирования и масс-спектрометрии с электрораспылением. Журнал хроматографии B
Журнал хроматографии B
752: 349–368. [PubMed] [Google Scholar]
42.
Бекхэм Г.Т., Дай З., Мэтьюз Дж.Ф., Момани М., Пейн К.М. и др. (2011) Использование гликозилирования для повышения активности целлюлазы. Текущее мнение в биотехнологии
23: 338–345. [PubMed] [Google Scholar]
43.
Лэнгсфорд М.Л., Гилкс Н.Р., Сингх Б., Мозер Б., Миллер Р.К. мл. и др. (1987)Гликозилирование бактериальных целлюлаз предотвращает протеолитическое расщепление между функциональными доменами. письма ФЭБС
225: 163–167. [PubMed] [Google Scholar]
44.
Бекхэм Г.Т., Бомбл И.Дж., Мэтьюз Дж.Ф., Тейлор С.Б., Реш М.Г. и др. (2010) O-гликозилированный линкер из целлюлазы семейства 7 Trichoderma reesei представляет собой гибкий неупорядоченный белок. Биофизический журнал
99: 3773–3781. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45.
Тинг С.Л., Макаров Д.Е., Ван З.Г. (2009)Кинетическая модель ферментативного действия целлюлазы. Журнал физической химии Б
113: 4970–4977. [Бесплатная статья PMC] [PubMed] [Google Scholar]
46.
Игараши К., Койвула А., Вада М., Кимура С., Пенттила М. и др. (2009) Высокоскоростная атомно-силовая микроскопия визуализирует процессивное движение целлобиогидролазы I Trichoderma reesei на кристаллической целлюлозе. Журнал биологической химии
284: 36186–36190. [Бесплатная статья PMC] [PubMed] [Google Scholar]
47.
Lantz SE, Goedegebuur F, Hommes R, Kaper T, Kelemen BR, et al. (2010)Инженерия белка Hypocrea jecorina CEL6A. Биотехнология для биотоплива
3: 20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
48.
Хайнзельман П., Сноу К.Д., Ву И., Нгуен С., Вильялобос А. и др. (2009)Семейство термостабильных грибковых целлюлаз, созданных путем рекомбинации, управляемой структурой. Труды Национальной академии наук Соединенных Штатов Америки
106: 5610–5615. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. Knowles JKC, Lentovaara P, Murray M, Sinnott ML (1988) Стереохимический курс действия целлобиозидгидролазы-I и гидролазы-II Trichoderma-Reesei. Журнал Химического общества-Chemical Communications: 1401–1402.
50.
Damude HG, Withers SG, Kilburn DG, Miller RC Jr, Warren RA (1995) Сайт-направленная мутация предполагаемых каталитических остатков эндоглюканазы CenA из Cellulomonas fimi. Биохимия
34: 2220–2224. [PubMed] [Google Scholar]
51.
Зоу Дж., Клейвегт Г.Дж., Штальберг Дж., Дригес Х., Неринкс В. и др. (1999) Кристаллографические доказательства искажения кольца субстрата и конформационных изменений белка во время катализа в целлобиогидролазе Ce16A из trichoderma reesei. Структура
7: 1035–1045. [PubMed] [Google Scholar]
52.
Варрот А., Лейдье С., Пелл Г., Макдональд Дж. М., Стик Р. В. и др. (2005) Штаммы Mycobacterium tuberculosis обладают функциональными целлюлазами. Журнал биологической химии
280: 20181–20184. [PubMed] [Google Scholar]
53.
Varrot A, Frandsen TP, Driguez H, Davies GJ (2002)Структура мутанта Cel6A D416A целлобиогидролазы Humicola insolens в комплексе с негидролизуемым аналогом субстрата, метилцеллобиозил-4-тио-бета-целлобиозидом, при 1,9A. Acta crystallographica Раздел D, Биологическая кристаллография. 58: 2201–2204. [PubMed] [Google Scholar]
58: 2201–2204. [PubMed] [Google Scholar]
54.
Дивне С., Штальберг Дж., Рейникайнен Т., Руохонен Л., Петтерссон Г. и др. (1994) Трехмерная кристаллическая структура каталитического ядра целлобиогидролазы I из Trichoderma reesei. Наука
265: 524–528. [PubMed] [Google Scholar]
55.
Stahlberg J, Divne C, Koivula A, Piens K, Claeyssens M, et al. (1996) Изучение активности и кристаллических структур каталитически дефицитных мутантов целлобиогидролазы I из Trichoderma reesei. Журнал молекулярной биологии
264: 337–349. [PubMed] [Google Scholar]
56.
Бозе Х., Марлин Т., Дюран Д., Перес Дж., Вернет А. и др. (2010) Богатые пролином белки слюны имеют расширенную конформацию. Биофизический журнал
99: 656–665. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57.
Аджубей А.А., Штернберг М.Ю. (1993) Левосторонние спирали полипролина II обычно встречаются в глобулярных белках. Журнал молекулярной биологии
229: 472–493. [PubMed] [Google Scholar]
58.
Кантарел Б.Л.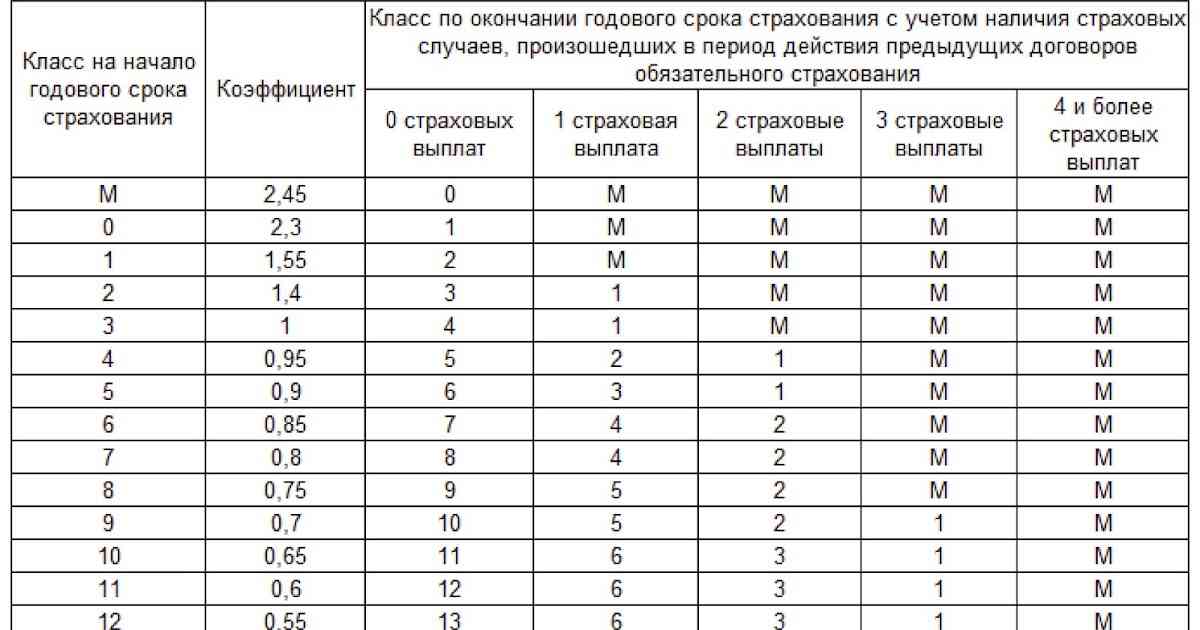 , Коутиньо П.М., Ранкурель С., Бернард Т., Ломбард В. и др. (2009 г.) База данных углеводно-активных ферментов (CAZy): экспертный ресурс по гликогеномике. Исследование нуклеиновых кислот
, Коутиньо П.М., Ранкурель С., Бернард Т., Ломбард В. и др. (2009 г.) База данных углеводно-активных ферментов (CAZy): экспертный ресурс по гликогеномике. Исследование нуклеиновых кислот
37: Д233–238. [Бесплатная статья PMC] [PubMed] [Google Scholar]
59.
Чжан Ю. Х., Линд Л. Р. (2004) На пути к общему пониманию ферментативного гидролиза целлюлозы: незакомплексованные целлюлазные системы. Биотехнология и биоинженерия
88: 797–824. [PubMed] [Google Scholar]
60.
Chundawat SP, Beckham GT, Himmel ME, Dale BE (2011)Разложение лигноцеллюлозной биомассы на топливо и химикаты. Ежегодный обзор химической и биомолекулярной инженерии
2: 121–145. [PubMed] [Академия Google]
61.
Himmel ME, Ding SY, Johnson DK, Adney WS, Nimlos MR, et al. (2007) Невосприимчивость к биомассе: инженерные установки и ферменты для производства биотоплива. Наука
315: 804–807. [PubMed] [Google Scholar]
62.
Кинг А.Дж., Крэгг С.М., Ли И., Даймонд Дж., Гилле М.Дж. и др. (2010)Молекулярный анализ переваривания лигноцеллюлозы морской изоподой в отсутствие кишечных микробов. Труды Национальной академии наук Соединенных Штатов Америки
Труды Национальной академии наук Соединенных Штатов Америки
107: 5345–5350. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63.
Colbourne JK, Pfrender ME, Gilbert D, Thomas WK, Tucker A, et al. (2011) Экочувствительный геном Daphnia pulex. Наука
331: 555–561. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64.
Лехтио Дж., Сугияма Дж., Густавссон М., Франссон Л., Линдер М. и др. (2003) Детерминанты специфичности связывания и аффинности модулей связывания целлюлозы семейства 1 и семейства 3. Труды Национальной академии наук Соединенных Штатов Америки
100: 484–489. [Бесплатная статья PMC] [PubMed] [Google Scholar]
65.
Симпсон П.Дж., Се Х., Болам Д.Н., Гилберт Х.Дж., Уильямсон М.П. (2000) Структурная основа лигандной специфичности модулей связывания углеводов семейства 2. Журнал биологической химии
275: 41137–41142. [PubMed] [Google Scholar]
66.
Борастон А.Б. (2005) Взаимодействие углеводсвязывающих модулей с нерастворимой некристаллической целлюлозой происходит по энтальпийной схеме. Биохимический журнал
Биохимический журнал
385: 479–484. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67.
Гарбузинский С.О., Лобанов М.Ю., Галзицкая О.В. (2004) Свернуть или развернуть?
Наука о белках
13: 2871–2877. [Бесплатная статья PMC] [PubMed] [Google Scholar]
68.
Crooks GE, Hon G, Chandonia JM, Brenner SE (2004) WebLogo: генератор последовательностей логотипов. Геномные исследования
14: 1188–1190. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69.
Adney WS, Jeoh T, Beckham GT, Chou YC, Baker JO и др. (2009) Изучение роли N-связанных гликанов в стабильности и активности целлобиогидролаз грибов с помощью мутационного анализа. Целлюлоза
16: 699–709. [Google Академия]
70.
Stals I, Sandra K, Devreese B, Van Beumen J, Claeyssens M (2004) Факторы, влияющие на гликозилирование целлюлаз Trichoderma reesei. II: N-гликозилирование корового белка Cel7A, выделенного из разных штаммов. гликобиология
14: 725–737. [PubMed] [Академия Google]
71.
Сталс И., Сандра К., Гейсенс С. , Контрерас Р., Ван Беумен Дж. и др. (2004) Факторы, влияющие на гликозилирование целлюлаз Trichoderma reesei. I: Постсекреторные изменения паттерна O- и N-гликозилирования Cel7A. гликобиология
, Контрерас Р., Ван Беумен Дж. и др. (2004) Факторы, влияющие на гликозилирование целлюлаз Trichoderma reesei. I: Постсекреторные изменения паттерна O- и N-гликозилирования Cel7A. гликобиология
14: 713–724. [PubMed] [Google Scholar]
72.
Годбол С., Декер С. Р., Ньевес Р. А., Адни В. С., Винзант Т. Б. и соавт. (1999)Клонирование и экспрессия целлобиогидролазы I Trichoderma reesei в Pichia pastoris. Биотехнологический прогресс
15: 828–833. [PubMed] [Академия Google]
73.
Jeoh T, Michener W, Himmel ME, Decker SR, Adney WS (2008) Последствия гликозилирования целлобиогидролазы для использования в преобразовании биомассы. Биотехнология для биотоплива
1: 10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
74.
Хелениус А., Эби М. (2001) Внутриклеточные функции N-связанных гликанов. Наука
291: 2364–2369. [PubMed] [Google Scholar]
75.
Игараси К., Учихаши Т., Койвула А., Вада М., Кимура С. и др. (2011) Пробки снижают гидролитическую эффективность целлюлазы на поверхности целлюлозы.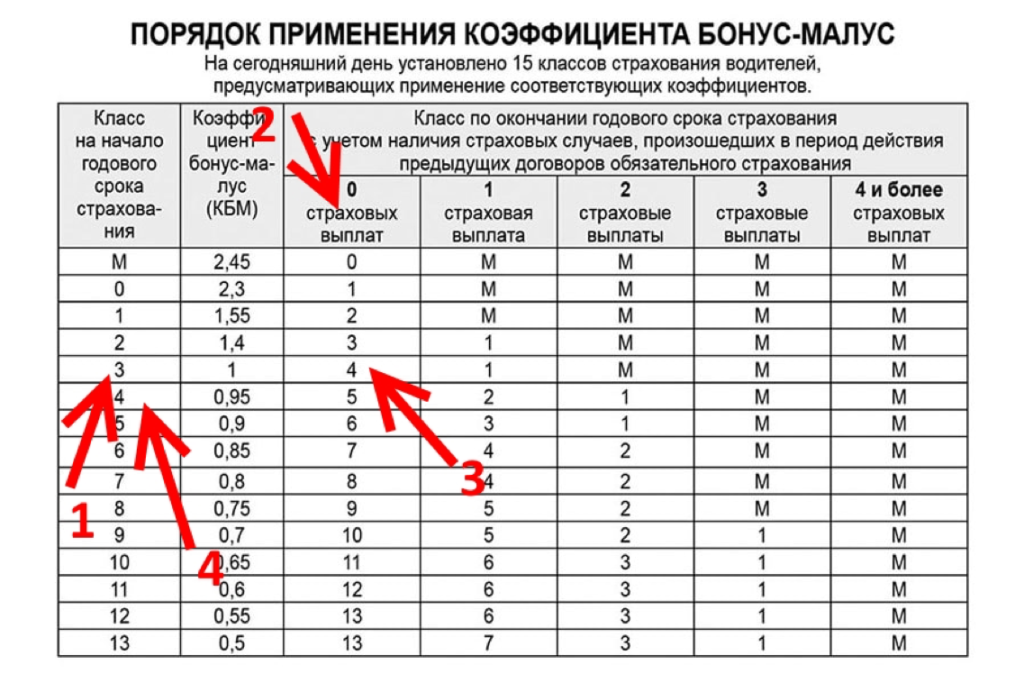 Наука
Наука
333: 1279–1282. [PubMed] [Google Scholar]
76.
Грассик А., Мюррей П.Г., Томпсон Р., Коллинз К.М., Бирнс Л. и соавт. (2004)Трехмерная структура термостабильной нативной целлобиогидролазы, CBH IB, и молекулярная характеристика гена cel7 нитчатого гриба Talaromyces emersonii. Европейский журнал биохимии/FEBS
271: 4495–4506. [PubMed] [Google Scholar]
77. Shaw M (2008) AnalystSoft’s StatPlus:mac. Даблклик: 20–21.
78.
Маккерелл А.Д., Башфорд Д., Беллотт М., Данбрэк Р.Л., Эвансек Д.Д. и др. (1998) Всеатомный эмпирический потенциал для молекулярного моделирования и изучения динамики белков. Журнал физической химии B
102: 3586–3616. [PubMed] [Google Scholar]
79.
Маккерелл А.Д., Фейг М., Брукс С.Л. (2004)Расширение рассмотрения энергетики позвоночника в белковых силовых полях. J Comp Chem
25: 1400–1415. [PubMed] [Google Scholar]
80.
Guvench O, Greene SN, Kamath G, Brady JW, Venable RM, et al. (2008) Аддитивное эмпирическое силовое поле для моносахаридов гексопиранозы.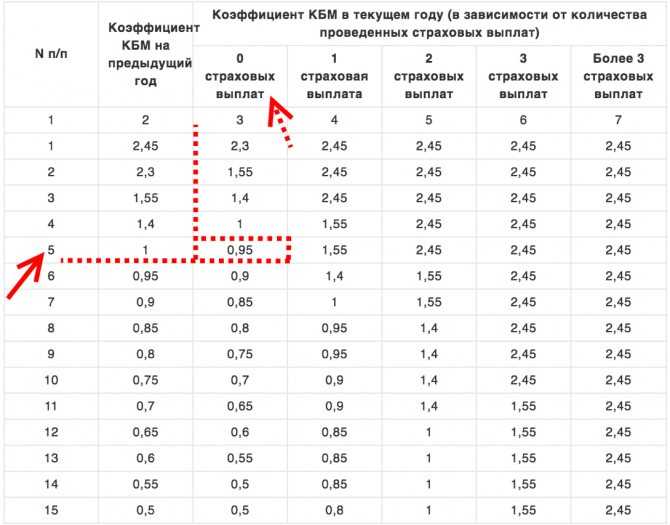 Журнал вычислительной химии
Журнал вычислительной химии
29: 2543–2564. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81.
Guvench O, Hatcher E, Venable RM, Pastor RW, MacKerell AD (2009)Аддитивное силовое поле всех атомов CHARMM для гликозидных связей между гексопиранозами. Журнал химической теории и вычислений
5: 2353–2370. [Бесплатная статья PMC] [PubMed] [Google Scholar]
82.
Чохолоусова Дж., Фейг М. (2006) Уравновешивание точного представления молекулярной поверхности в обобщенных формализмах Борна с устойчивостью интегратора в молекулярно-динамическом моделировании. Журнал вычислительной химии
27: 719–729. [PubMed] [Google Scholar]
83.
Lee MS, Salsbury FR, Brooks CL (2002) Новые обобщенные методы Борна. Журнал химической физики
116: 10606. [Google Scholar]
84.
Yeh IC, Wallqvist A (2009)Структура и динамика образования сквозной петли пентапептида Cys-Ala-Gly-Gln-Trp в неявных растворителях. Журнал физической химии B
113: 12382–12390. [PubMed] [Google Scholar]
85.
Фейг М., Онуфриев А., Ли М.С., Им В., Кейс Д.А. и соавт. (2003) Сравнение эффективности обобщенных методов Борна и Пуассона при расчете энергии электростатической сольватации для белковых структур. Журнал вычислительной химии
25: 265–284. [PubMed] [Академия Google]
86.
Брукс Б.Р., Брукс С.Л. III, Маккерелл А.Д. мл., Нильссон Л., Петрелла Р.Дж. и др. (2009) CHARMM: программа биомолекулярного моделирования. Журнал вычислительной химии
30: 1545–1614. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Ryckaert J, Ciccotti G, Berendsen H (1977) J Comput Phys 23.
88.
Лин Э., Шелл М.С. (2009)Конвергенция и гетерогенность в сворачивании пептидов с помощью молекулярной динамики обмена репликами. Журнал химической теории и вычислений
5: 2062–2073. [PubMed] [Академия Google]
89.
Абрахам М.Дж., Греди Дж.Е. (2008)Обеспечение эффективности смешивания моделирования молекулярной динамики с обменом репликами. Журнал химической теории и вычислений
4: 1119–1128. [PubMed] [Google Scholar]
90.
Case DA, Cheatham TE, Darden T, Gohlke H, Luo R, et al. (2005) Программы биомолекулярного моделирования Amber. J Comp Chem
26: 1668–1688. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91.
Shao JY, Tanner SW, Thompson N, Cheatham TE (2007) Кластеризация траекторий молекулярной динамики: 1. Характеристика производительности различных алгоритмов кластеризации. Журнал химической теории и вычислений
3: 2312–2334. [PubMed] [Академия Google]
Техническая адекватность и приемлемость измерения на основе учебной программы и показателей академического прогресса
%PDF-1.7
%
1 0 объект
>
эндообъект
5 0 объект
>
эндообъект
2 0 объект
>
ручей
2017-07-01T00:57:37-07:002017-07-01T00:57:37-07:002017-07-01T00:57:37-07:00Заявитель ПриложениеPDF Pro 5.5uuid:f7042e6e-a624-11b2-0a00- 782dad000000uuid:f70449e9-a624-11b2-0a00-a061fbeefd7fapplication/pdf
- Техническая адекватность и приемлемость измерения на основе учебной программы и показателей успеваемости
Prince 9. 0 rev 5 (www.princexml.com)AppendPDF Pro 5.5 Linux Kernel 2.6 64bit 2 октября 2014 г. Библиотека 10.1.0
0 rev 5 (www.princexml.com)AppendPDF Pro 5.5 Linux Kernel 2.6 64bit 2 октября 2014 г. Библиотека 10.1.0
конечный поток
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
эндообъект
6 0 объект
>
эндообъект
7 0 объект
>
эндообъект
8 0 объект
>
эндообъект
90 объект
>
эндообъект
10 0 объект
>
/MediaBox [0 0 612 792]
/Родитель 8 0 Р
/Ресурсы >
/ProcSet [/PDF /текст /ImageC]
/XОбъект >
>>
/Тип /Страница
>>
эндообъект
11 0 объект
>
эндообъект
12 0 объект
>
эндообъект
13 0 объект
>
эндообъект
14 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/Свойства >
/MC1 77 0 Р
/MC2 78 0 Р
>>
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
15 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792. 0]
0]
/Тип /Страница
>>
эндообъект
16 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
17 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
18 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
19 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792.0]
/Тип /Страница
>>
эндообъект
20 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
21 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
22 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792,0]
/Тип /Страница
>>
эндообъект
23 0 объект
>
/ExtGState >
/Шрифт >
/ProcSet [/PDF /текст]
/XОбъект >
>>
/Повернуть 0
/TrimBox [0,0 0,0 612,0 792.