Содержание
Этиленгликоль, структурная формула, химические, физические свойства
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт.
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Атом кислорода в спиртах находится в состоянии sp3-гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp3-гибридные орбитали, а еще две 2sp3-гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108о.
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
| Например, этиленгликоль взаимодействует с калием с образованием гликолята калия и водорода. |
CH2(OH)-CH2OH + 2K → CH2(OK)-CH2OK + H2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
CH2(OH)-CH2OH + 2HBr → CH2Br-CH2Br + 2H2O
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль: |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180оС) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
2C2H4(OH)2 + 5O2 = 4CO2 + 6H2O
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
CH2(OH)-CH2OH → CHO-CHO + 2H2
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
CH2Cl-CH2Cl + 2NaOH → CH2OH-CH2OH + 2NaCl
2. Гидрирование карбонильных соединений
Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2→ CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
| Например, этилен реагирует с водным раствором перманганата калия при низкой температуре с образованием этиленгликоля (этандиол-1,2) |
Понравилось это:
Нравится Загрузка. ..
..
Моноэтиленгликоль | (Ch3OH)2
Моноэтиленгликоль (также известный как МЭГ, ЭГ, 1,2-этандиол или 1,2-дигидроксиэтан) представляет собой органическое соединение с формулой C2H6O2. Это слегка вязкая жидкость, прозрачная, бесцветная, со сладким вкусом, практически без запаха. Он смешивается с водой, спиртами и многими другими органическими соединениями и в основном используется в промышленности для производства полиэфирных волокон и в качестве компонента в производстве антифризов, охлаждающих жидкостей, антиобледенителей для самолетов и антиобледенителей.
Технические свойства
Технические свойства моно -этиленгликоля:
Молекулярная формула: C 2 H 6 O 2 / (CH 2 OH) 2 / HOCH 2 CH 2 2 / HOCH 2 CH 2 OH) OH
Синонимы: моноэтиленгликоль, моноэтилгликоль, мегагликоль, этиленгликоль, 1,2-этандиол, этан-1,2-диол, ЭГ, технический гликоль, 1,2-дигидроксиэтан, гликолевый спирт.
Номер Cas: 107-21-1
Молекулярная масса: 62,07 г/моль
Точная масса: 62,036779 г/моль
Температура воспламенения: 232 °F/111,11 °C
Температура самовоспламенения: 770 °F / 410 °C
Температура кипения: 387,7 °F / 190 мм рт. Температура плавления: 9 °F / -12,8 °C
Давление пара: 0,06 мм рт. ст. при 68 °F / 20 °C
Плотность: 1,115 при 68 °F
Log P: -1,69 Произведено?
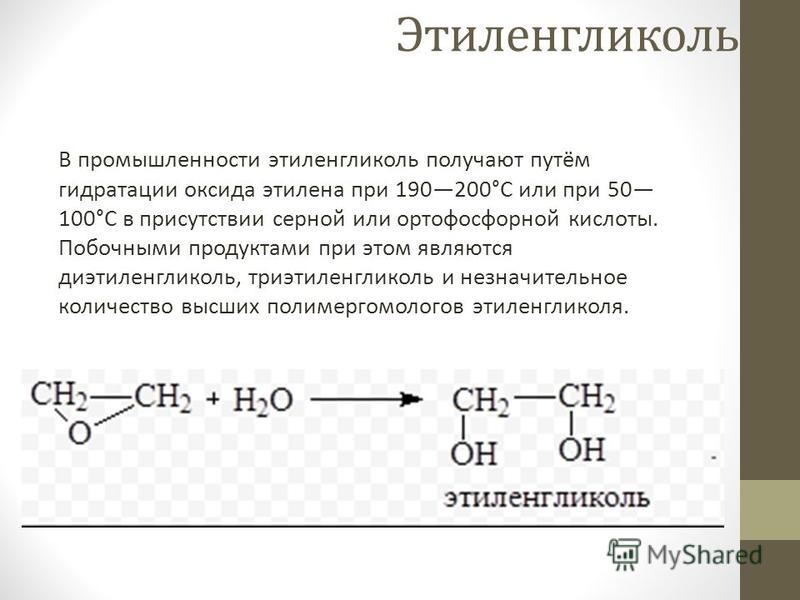
Промежуточный оксид этилена используется для превращения этилена (этена) в этиленгликоль. Оксид этилена получают путем окисления, а затем вводят в реакцию с водой с получением моноэтиленгликоля с ди- и триэтиленгликолями в качестве побочных продуктов:
C 2 H 4 O + H 2 O → HOCH 2 CH 2 OH
Кислоты и основания могут катализировать эту реакцию, или она может происходить при повышенных температурах pH. Выход до 90% может быть достигнут при кислом или нейтральном рН с большим избытком воды.
Моноэтиленгликоль также получают гидрированием диметилоксалата в присутствии медного катализатора или ацетоксилированием этилена.
Мировой спрос на моноэтиленэтиленгликоль (МЭГ) высок: рынок оценивается в 25 миллиардов долларов, и ожидается, что он будет расти на 6% ежегодно до 2024 года. Азиатско-Тихоокеанский регион. Спрос наиболее высок в Китае, где потребляется около 70% мирового производства МЭГ.
Как хранится и распределяется моноэтиленгликоль?
Хранение и обращение
В соответствии с NFPA 704 моноэтиленгликоль оценивается как 0 за нестабильность, что указывает на то, что моноэтиленгликоль обычно стабилен. Пары моноэтиленгликоля тяжелее воздуха и будут перемещаться в близлежащие районы. Из-за высокой температуры воспламенения 111,11 °C химическое вещество имеет рейтинг воспламеняемости 1, что указывает на то, что для воспламенения и возгорания требуется значительный предварительный нагрев. Однако при хранении МЭГ следует держать вдали от источников тепла, искр и открытого огня. В случае возникновения пожара для тушения пожара следует использовать спиртостойкую пену или распыленную воду, уделяя особое внимание предотвращению попадания пролитой жидкости в источники воды или канализацию.
В случае возникновения пожара для тушения пожара следует использовать спиртостойкую пену или распыленную воду, уделяя особое внимание предотвращению попадания пролитой жидкости в источники воды или канализацию.
Моноэтиленгликоль Опасность для здоровья
Химическое вещество обладает высокой токсичностью при проглатывании, при этом основная опасность заключается в сладком вкусе, способствующем дальнейшему употреблению; это увеличивает опасность для животных и детей. Проглатывание достаточного количества является смертельным, если его не лечить, поскольку этиленгликоль окисляется в организме до гликолевой кислоты, а затем до токсического химического вещества, щавелевой кислоты. Проглатывание МЭГ влияет на центральную нервную систему, сердце и может вызвать острую почечную недостаточность.
Воздействие паров моноэтиленгликоля на глаза может вызывать раздражение, поэтому рекомендуется носить защитные очки при работе с химическим веществом. Воздействие этиленгликоля в жидкой форме может привести к более серьезным повреждениям глаз. При попадании в глаза немедленно промыть большим количеством воды и обратиться за медицинской помощью.
При попадании в глаза немедленно промыть большим количеством воды и обратиться за медицинской помощью.
Воздействие МЭГ на кожу также может вызывать раздражение, поэтому следует носить перчатки. Если кожа все же загрязнилась, следует снять всю мокрую одежду и промыть кожу водой. Ингаляционное воздействие высоких уровней этиленгликоля может вызвать раздражение и потенциально невыносимый респираторный дискомфорт и кашель. В случае чрезмерного вдыхания пострадавший должен быть удален из окружающей среды, дышать свежим воздухом и обратиться за медицинской помощью.
Моноэтиленгликоль Использование
Моноэтиленгликоль чаще используется в качестве предшественника полимера, а также в антифризах, а также в самых разных отраслях промышленности.
Прекурсор полимера
Существует большой мировой спрос на моноэтиленгликоль в пластмассовой промышленности, поскольку он является жизненно важным ингредиентом в производстве полиэфирных волокон, пленок и смол, одним из которых является полиэтилентерефталат (ПЭТФ).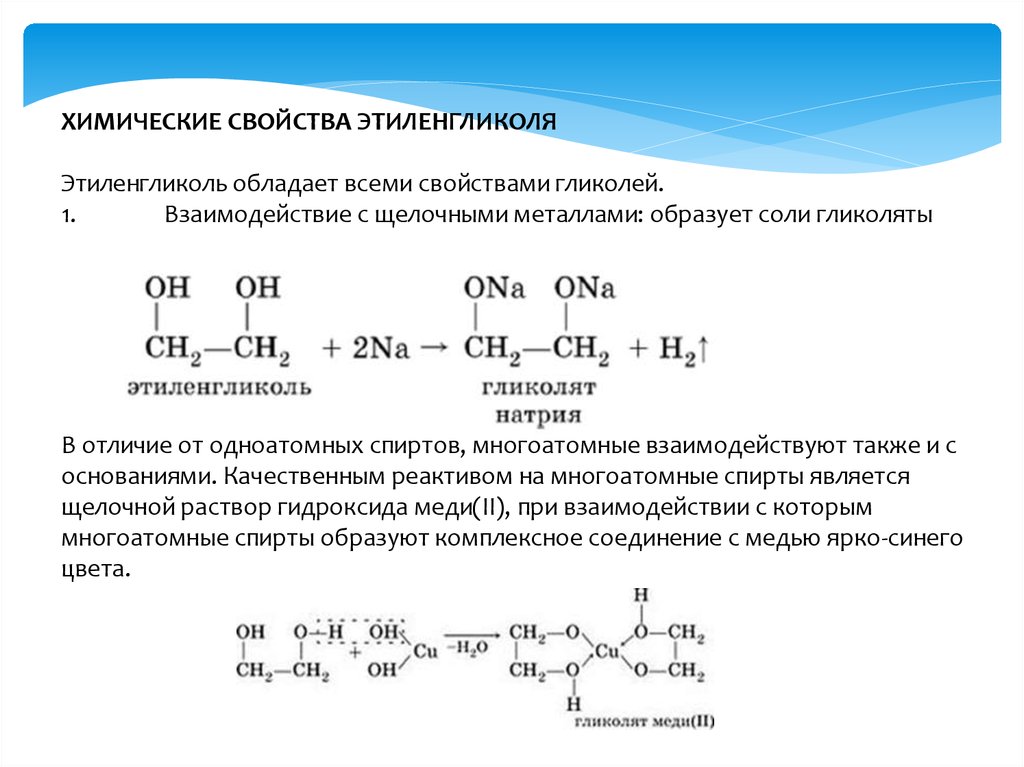 ПЭТ получают путем нагревания этиленгликоля с терефталевой кислотой в ходе реакции этерификации. Затем это химическое вещество превращается в пластиковые бутылки, контейнеры для микроволновой печи и даже используется в текстильной промышленности. Подсчитано, что 70-80% всего потребляемого МЭГ используется в качестве промежуточного химического вещества в этих процессах производства полиэфира.
ПЭТ получают путем нагревания этиленгликоля с терефталевой кислотой в ходе реакции этерификации. Затем это химическое вещество превращается в пластиковые бутылки, контейнеры для микроволновой печи и даже используется в текстильной промышленности. Подсчитано, что 70-80% всего потребляемого МЭГ используется в качестве промежуточного химического вещества в этих процессах производства полиэфира.
Антифриз
Моноэтиленгликоль в основном используется в промышленности в качестве антифриза, где он является компонентом при производстве антифриза, охлаждающих жидкостей, антиобледенителей для самолетов и антиобледенителей из-за его способности снижать температуру замерзания воды. В то время как чистый этиленгликоль замерзает при -12,9 ° C, при смешивании с водой он может значительно снизиться примерно до -45 ° C с 60% этиленгликоля и 40% воды. Горькие ароматизаторы обычно добавляют к МЭГ, используемому в антифризе, чтобы изменить сладкий вкус, который может побудить детей и животных потреблять химическое вещество.
Другое промышленное использование
Моноэтиленгликоль также используется в производстве алкидных смол, которые используются для образования пленки в красках, эмалях и лаках. В газовой промышленности этиленгликоль используется для удаления паров воды из газа перед его дальнейшей обработкой. Здесь он также используется в качестве осушителя в газопроводах, чтобы остановить образование клатратов.
В электронной промышленности МЭГ используется в качестве промежуточного химического вещества при производстве конденсаторов. Или для лечения и профилактики грибков и гнили в древесине можно использовать моноэтиленгликоль, особенно полезный для выставок и музеев. В области медицины этиленгликоль можно использовать для производства вакцин, хотя он не присутствует в конечной вводимой вакцине. Это второстепенный ингредиент в различных чистящих средствах, в том числе в средствах для очистки экранов для электроники, где он используется в сочетании с изопропиловым спиртом.
Solventis в качестве поставщика моноэтиленгликоля
Solventis является ведущим оптовым поставщиком и дистрибьютором моноэтиленгликоля или МЭГ в Великобритании, Европе и во всем мире. Как компания с офисами в Великобритании и Бельгии, мы гордимся тем, что можем предложить индивидуальный и эффективный сервис, а также очень конкурентоспособные цены.
Как компания с офисами в Великобритании и Бельгии, мы гордимся тем, что можем предложить индивидуальный и эффективный сервис, а также очень конкурентоспособные цены.
Благодаря нашему современному заводу в Антверпене, Бельгия, мы можем гарантировать качество, эффективность, безопасность и заботу об окружающей среде для всего нашего ассортимента продукции, которая не имеет себе равных. Пожалуйста, свяжитесь с нами для получения дополнительной информации о нашем моноэтиленгликоле или любом гликоле из нашего ассортимента, заполнив форму запроса или по телефону +44 (0)1483 203224.
Этиленгликоль – Использование, молярная масса, свойства и часто задаваемые вопросы
Этиленгликоль – это «органическое соединение», которое чрезвычайно токсично. Это прозрачная вязкая жидкость без запаха со сладким вкусом, кипящая при температуре 388,4°F (198°C); чаще всего он используется в автомобильных антифризах. Раствор этиленгликоля и воды в соотношении 1:1 кипит при 264,2°F (129°C) и замерзает при -34,6°C (-37°C), служащий отличным хладагентом в автомобильных радиаторах.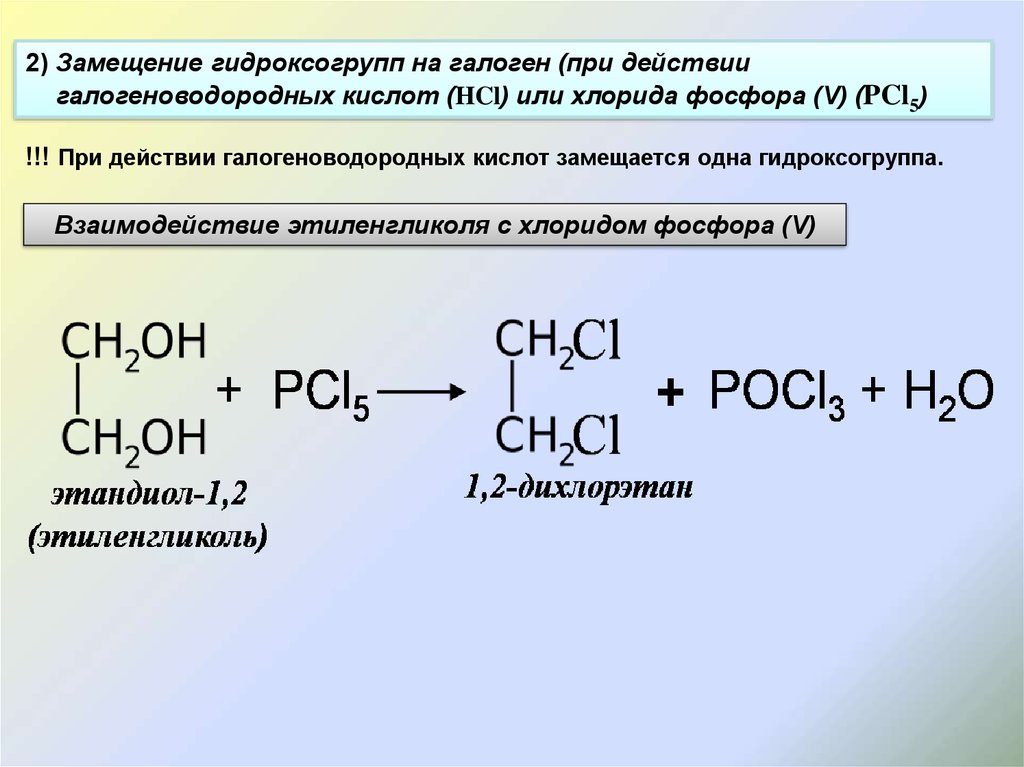
Этиленгликоль находит широкое применение в промышленном и коммерческом секторах. Этиленгликоль означает гликоль, полученный из этилена. Химикат обладает свойствами как антифриза, так и охлаждающей жидкости. Этиленгликоль поддерживает работу вашего автомобиля в зимний период, не давая двигателю замерзнуть. Точно так же в летний сезон он действует как охлаждающая жидкость, которая поддерживает работу вашего автомобиля, предотвращая перегрев двигателя.
Характеристики этиленгликоля
Внешний вид: прозрачная, бесцветная, сиропообразная (вязкая) жидкость при температуре. Часто окрашивается в флуоресцентный желто-зеленый цвет при использовании в автомобильных антифризах.
Описание: гликоль может быть полезным промышленным соединением, которое содержится во многих потребительских товарах. Примеры включают антифриз, жидкости для гидравлических тормозов, некоторые чернила для прокладок, шариковые ручки, растворители, краски, пластмассы, пленки и косметику.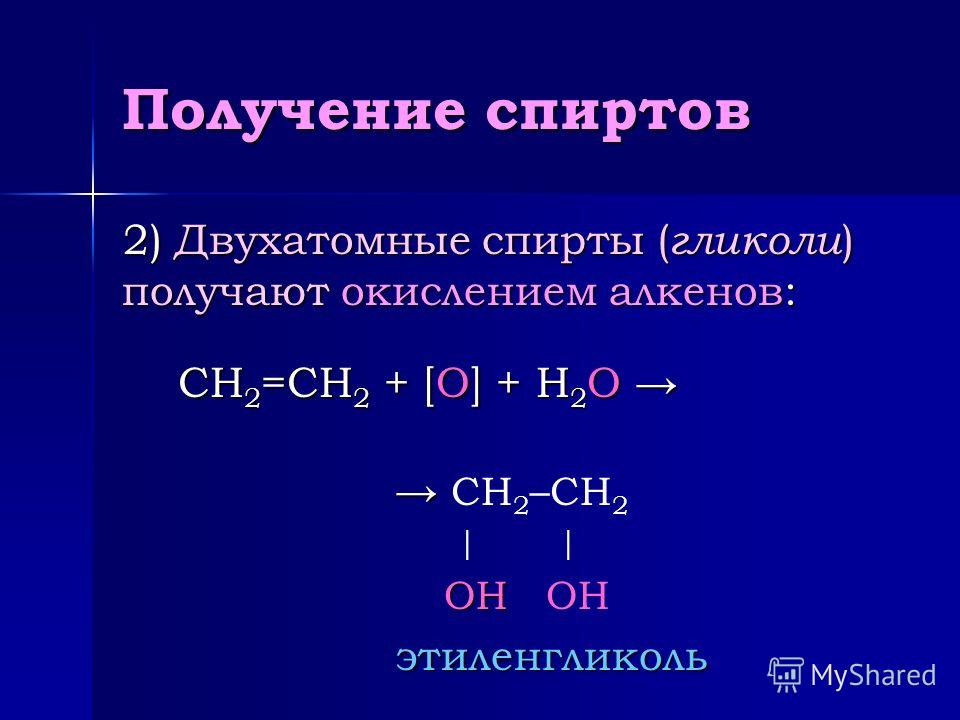 Это также может быть фармацевтический носитель. Этиленгликоль имеет сладкий вкус и обычно попадает внутрь случайно или преднамеренно. Этиленгликоль распадается на токсичные соединения в организме. Этиленгликоль и его токсичные побочные продукты сначала поражают центральную нервную систему, затем сердце, затем почки. Проглатывание достаточного количества также может привести к смерти. Этиленгликоль обычно не имеет запаха.
Это также может быть фармацевтический носитель. Этиленгликоль имеет сладкий вкус и обычно попадает внутрь случайно или преднамеренно. Этиленгликоль распадается на токсичные соединения в организме. Этиленгликоль и его токсичные побочные продукты сначала поражают центральную нервную систему, затем сердце, затем почки. Проглатывание достаточного количества также может привести к смерти. Этиленгликоль обычно не имеет запаха.
Способы распространения:
Воздух в помещении: гликоль может выделяться в воздух в помещении в виде жидкого спрея (аэрозоля), пара или тумана.
Вода: Этиленгликоль может загрязнять воду.
Пищевые продукты: Этиленгликоль может загрязнять пищевые продукты.
Наружный воздух: гликоль может выделяться в наружный воздух в виде жидкого аэрозоля (аэрозоля), пара или тумана.
Сельское хозяйство: Если этиленгликоль высвобождается в виде жидкого спрея (аэрозоля) или тумана, он может загрязнять сельскохозяйственные продукты. Если гликоль выделяется в виде пара, он вряд ли загрязнит сельскохозяйственные продукты.
Если гликоль выделяется в виде пара, он вряд ли загрязнит сельскохозяйственные продукты.
Пути воздействия
Системная токсичность гликоля может возникнуть при проглатывании. Вдыхание паров гликоля может раздражать глаза и легкие, но вряд ли вызовет системную токсичность. Этиленгликоль плохо впитывается через кожу, поэтому системная токсичность маловероятна. Воздействие на глаза может вызвать местные неблагоприятные последствия для здоровья, но маловероятно, что это приведет к системной токсичности.
Структура этиленгликоля
Этиленгликоль также известен как моноэтиленгликоль. Он образуется при химической реакции этиленоксида с водой. Химическая формула этиленгликоля: \[C_{2}H_{6}O_{2}\]. Химическая структура этиленгликоля следующая:
(Изображение скоро будет загружено)
Каково применение этиленгликоля?
Этиленгликоль может быть полезным промышленным соединением, которое содержится во многих потребительских товарах. Примеры включают антифриз, жидкости для гидравлических тормозов, некоторые чернила для прокладок, шариковые ручки, растворители, краски, пластмассы, пленки и косметику. Это также может быть фармацевтический носитель.
Примеры включают антифриз, жидкости для гидравлических тормозов, некоторые чернила для прокладок, шариковые ручки, растворители, краски, пластмассы, пленки и косметику. Это также может быть фармацевтический носитель.
Этиленгликоль представляет собой вязкую жидкость, используемую в качестве сырья для производства:
Ингредиент для изготовления автомобильных охлаждающих жидкостей и антифризов.
Они широко используются в производстве полиэфирных волокон.
Это реагент, используемый при производстве взрывчатых веществ, синтетических восков и алкидных смол.
Он также используется в производстве стекловолокна для ванн, шаров для боулинга и гидроциклов.
Он также используется в производстве промышленных хладагентов для вентиляции, газовых компрессоров, систем кондиционирования, отопления и катков.

Эффекты гликоля
Отравление этиленгликолем может вызвать аритмии и коронарную недостаточность. Токсичность гликоля характеризуется осмолярным разрывом и ацидозом с увеличенным анионным интервалом. Нефротоксичность после приема гликоля обычно возникает через 24-72 часа после острого воздействия.
Химическая опасность: Этиленгликоль обычно реагирует с сильными окислителями и кислотами.
Опасность взрыва: Нижний предел взрываемости (воспламенения) в воздухе (НПВ): 3,2%. Верхний предел взрываемости (воспламеняемости) в воздухе (ВПВ): 15,3%.
Противопожарная информация: Этиленгликоль горюч.
Тушить пожары, используя средство, подходящее для вида окружающего пожара.
Используйте «спиртовую» пену, сухой химикат или \[CO_{2}\].
Не допускать стока воды из канализации и источников воды.
Первоначальная изоляция и дистанции защитных действий:
Изолировать цистерны, железнодорожные вагоны и автоцистерны в общей сложности на расстоянии 0,5 мили (800 м) от огня.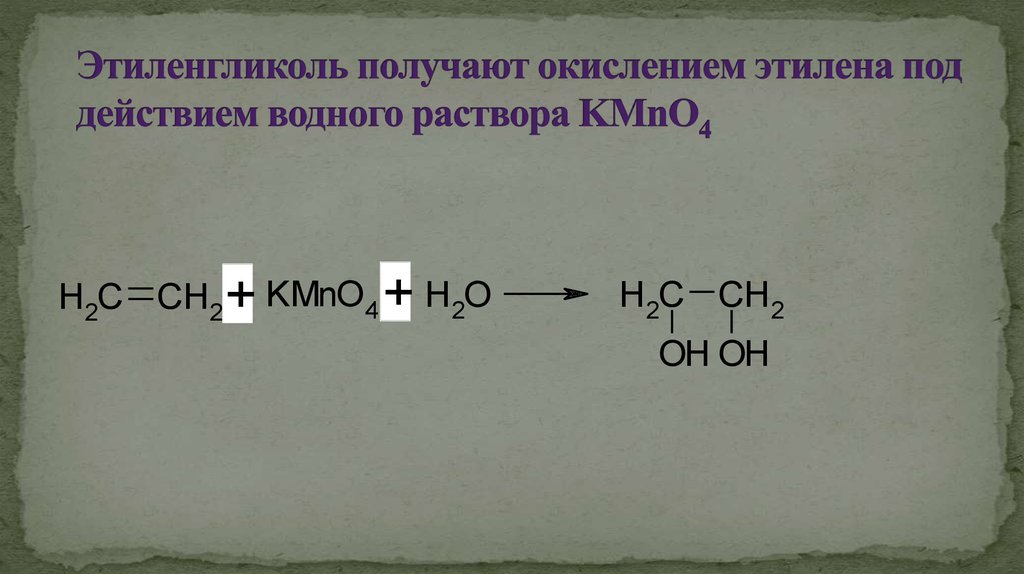 Кроме того, вы можете рассмотреть первоначальную эвакуацию на 0,5 мили (800 м) в целом.
Кроме того, вы можете рассмотреть первоначальную эвакуацию на 0,5 мили (800 м) в целом.
Этот агент не указан в Таблице DOT ERG 2004 по начальной дистанции изоляции и защитного действия.
Немедленно изолируйте место разлива или утечки гликоля на расстоянии не менее 100 м (330 футов). Эти и подобные другие меры общественной безопасности перечислены в разделе руководства DOT ERG 2004, обведенном оранжевой рамкой (Руководство 111).
Физические опасности:
Пары тяжелее воздуха и могут скапливаться в плохо проветриваемых, низменных или закрытых помещениях (например, в канализации, подвалах и резервуарах).
В опасных количествах может быстро развиваться в закрытых, плохо проветриваемых и низменных помещениях. исключая эти районы и против ветра.
Какова молярная масса этиленгликоля?
Молярная масса любого химического соединения представляет собой сумму атомных масс каждого элемента, входящего в его состав. Этиленгликоль состоит из 6 атомов водорода, двух атомов углерода и двух атомов кислорода. Итак, M (молярная масса этиленгликоля) = 12 (атомная масса углерода) x 2 + 1 (атомная масса водорода) x 6 + 16 (атомная масса кислорода) x 2 = 62,07 (г/моль).
Этиленгликоль состоит из 6 атомов водорода, двух атомов углерода и двух атомов кислорода. Итак, M (молярная масса этиленгликоля) = 12 (атомная масса углерода) x 2 + 1 (атомная масса водорода) x 6 + 16 (атомная масса кислорода) x 2 = 62,07 (г/моль).
Свойства
Химическая формула: \[ C_{2}H_{6}O_{2} \]
Растворимость в воде: растворим
Плотность:
Жидкость: 1,11 при 68°F (20°C)
Пар: 2,14 (воздух = 1)Воспламеняемость: Горючая жидкость
0
Температура вспышки: 9°C (
- )
Потенциал ионизации: нет
Log K Бензол-вода: не определено
log kow (по оценкам): -1,36
Стычка плавления: 9 ° F (-13 ° C)
Молекулярная масса: 62,07
Solecular in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in in soladhable: 62,07
.
 , глицерин, уксусная кислота, ацетон и аналогичные кетоны, альдегиды, пиридин и аналогичные основания каменноугольной смолы. Кроме того, он слабо растворим в эфире. Практически нерастворим в бензоле и его гомологах, хлорированных углеводородах, петролейном эфире и маслах.
, глицерин, уксусная кислота, ацетон и аналогичные кетоны, альдегиды, пиридин и аналогичные основания каменноугольной смолы. Кроме того, он слабо растворим в эфире. Практически нерастворим в бензоле и его гомологах, хлорированных углеводородах, петролейном эфире и маслах.Удельный вес: 1,11
Давление паров: 0,06 мм рт.ст. при 68°F (20°C)
Летучесть: Не определено
Как производить гликольэтилен?
Существуют различные методы производства этиленгликоля; некоторые из них приведены ниже:
Из этилена
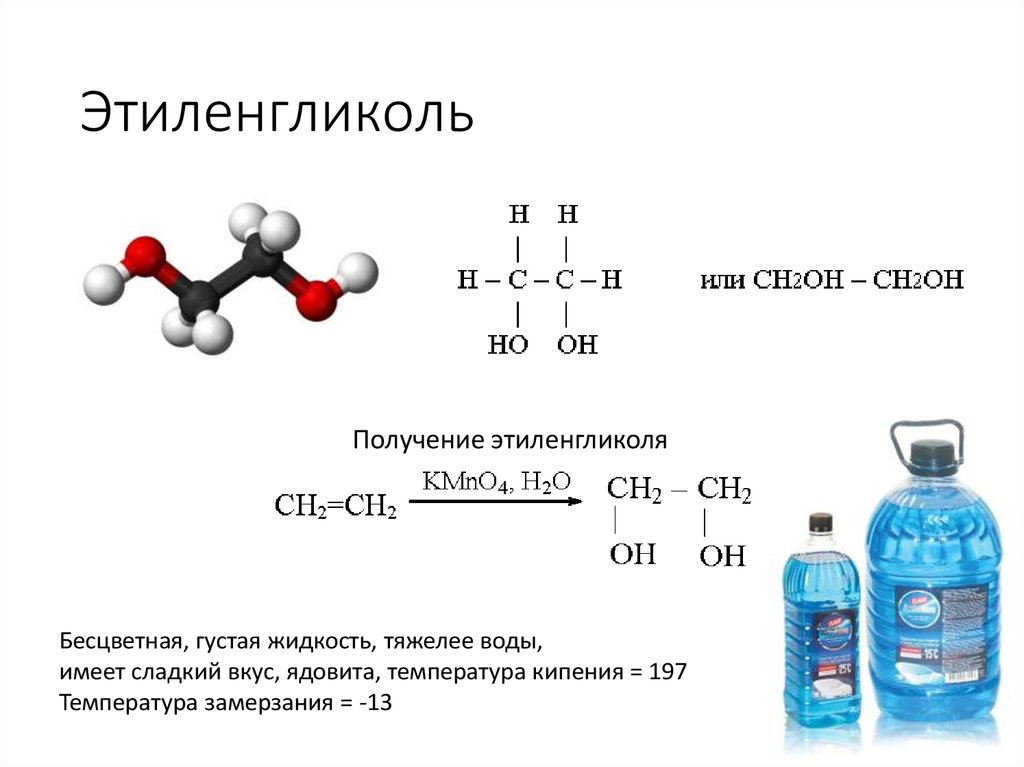
Гидроксилирование этилена дает этиленгликоль. При обработке реактивом Байера (холодный разбавленный щелочной раствор перманганата калия) этилен приводит к гидроксилированию по обоим атомам углерода.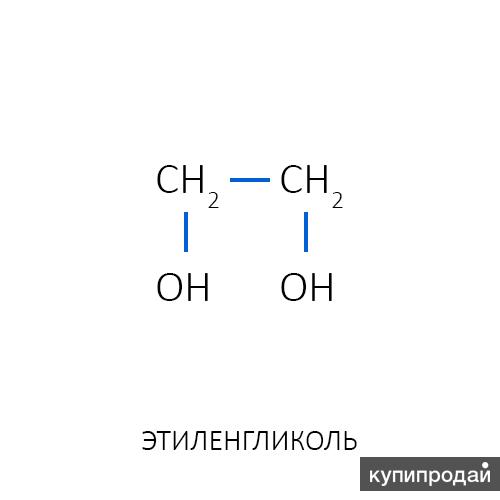
Таким образом, этиленгликоль получают из этилена.
Из окиси этилена
Гидролиз окиси этилена дает этиленгликоль. Окись этилена, полученная каталитическим окислением этилена при гидролизе в присутствии кислоты при высокой температуре, дает окись этилена.
Каким образом этиленгликоль может попасть в окружающую среду?
Этиленгликоль также может попасть в окружающую среду при утилизации продуктов, которые его содержат.
Существуют различные пути распространения этиленгликоля в окружающую среду.
Воздух в помещении. Этиленгликоль может выбрасываться во внутренние помещения, загрязняя воздух в виде жидкого аэрозоля (аэрозоля), пара или тумана.
Вода. Этиленгликоль может загрязнять воду.
 Он не имеет запаха и легко смешивается с водой.
Он не имеет запаха и легко смешивается с водой.Пищевые продукты. Этиленгликоль представляет собой соединение, которое может загрязнять пищевые продукты.
Вне помещения — Этиленгликоль может выбрасываться на улицу, загрязняя воздух в виде жидкого аэрозоля (аэрозоля), пара или тумана.
Сельское хозяйство. Если этиленгликоль высвобождается в виде жидкого спрея (аэрозоля) или тумана, он может загрязнить сельскохозяйственные продукты; однако маловероятно, что он загрязнит сельскохозяйственные продукты, если будет выпущен в виде паров.
Интересные факты
Этиленгликоль смешивается с водой.
Это самый простой представитель семейства гликолей.

Легко воспламеняется.
Для разложения этиленгликоля в воздухе требуется около десяти дней.
Активно реагирует с окислителями.
При нагревании для разложения выделяется едкий дым. Он выделяет раздражающие пары, которые являются опасными.
Знаете ли вы?
Этиленгликоль слишком ядовит для людей и домашних животных. Это может привести к тяжелым заболеваниям и, в крайних случаях, даже к смерти. Сложность заключается в том, что вкус этиленгликоля нравится домашним животным, таким как собаки и кошки. Столовая ложка этиленгликоля смертельна для вашей собаки, а одной чайной ложки достаточно для смерти кошки.
 Если случайно ваш питомец проглотил химическое вещество, следует немедленно дать противоядие.
Если случайно ваш питомец проглотил химическое вещество, следует немедленно дать противоядие.Этиленгликоль является быстродействующим токсичным веществом. Напротив, пропиленгликоль считается безопасным в качестве добавки к продуктам питания и лекарствам.
Вдыхание небольших количеств этиленгликоля вызывает смерть. Его также принимают намеренно при попытках самоубийства. Этиленгликоль представляет собой сладкую жидкость без запаха, которая содержится в моющих средствах.
Этиленгликоль (ЭГ) также представляет собой бесцветную жидкость без запаха и горько-сладкого вкуса. Он имеет множество бытовых и коммерческих применений. Этиленгликоль также является «токсичным спиртом». Это означает, что хотя он химически похож на этанол (активный компонент алкогольных напитков). Кроме того, он гораздо более ядовит при употреблении.


 , глицерин, уксусная кислота, ацетон и аналогичные кетоны, альдегиды, пиридин и аналогичные основания каменноугольной смолы. Кроме того, он слабо растворим в эфире. Практически нерастворим в бензоле и его гомологах, хлорированных углеводородах, петролейном эфире и маслах.
, глицерин, уксусная кислота, ацетон и аналогичные кетоны, альдегиды, пиридин и аналогичные основания каменноугольной смолы. Кроме того, он слабо растворим в эфире. Практически нерастворим в бензоле и его гомологах, хлорированных углеводородах, петролейном эфире и маслах. Он не имеет запаха и легко смешивается с водой.
Он не имеет запаха и легко смешивается с водой.
 Если случайно ваш питомец проглотил химическое вещество, следует немедленно дать противоядие.
Если случайно ваш питомец проглотил химическое вещество, следует немедленно дать противоядие.